Dans toute expérience électrochimique impliquant un courant, l'électrode auxiliaire (également appelée contre-électrode) a un objectif principal : compléter le circuit électrique. Elle fonctionne en tandem avec l'électrode de travail, permettant au courant de circuler afin que la réaction d'intérêt puisse être pilotée et étudiée, tout en assurant que la mesure reste stable et précise.
La véritable fonction de l'électrode auxiliaire est de protéger l'intégrité de votre mesure. En gérant l'intégralité du flux de courant, elle isole l'électrode de référence, garantissant que le potentiel à l'électrode de travail est mesuré par rapport à une référence stable et non perturbée.

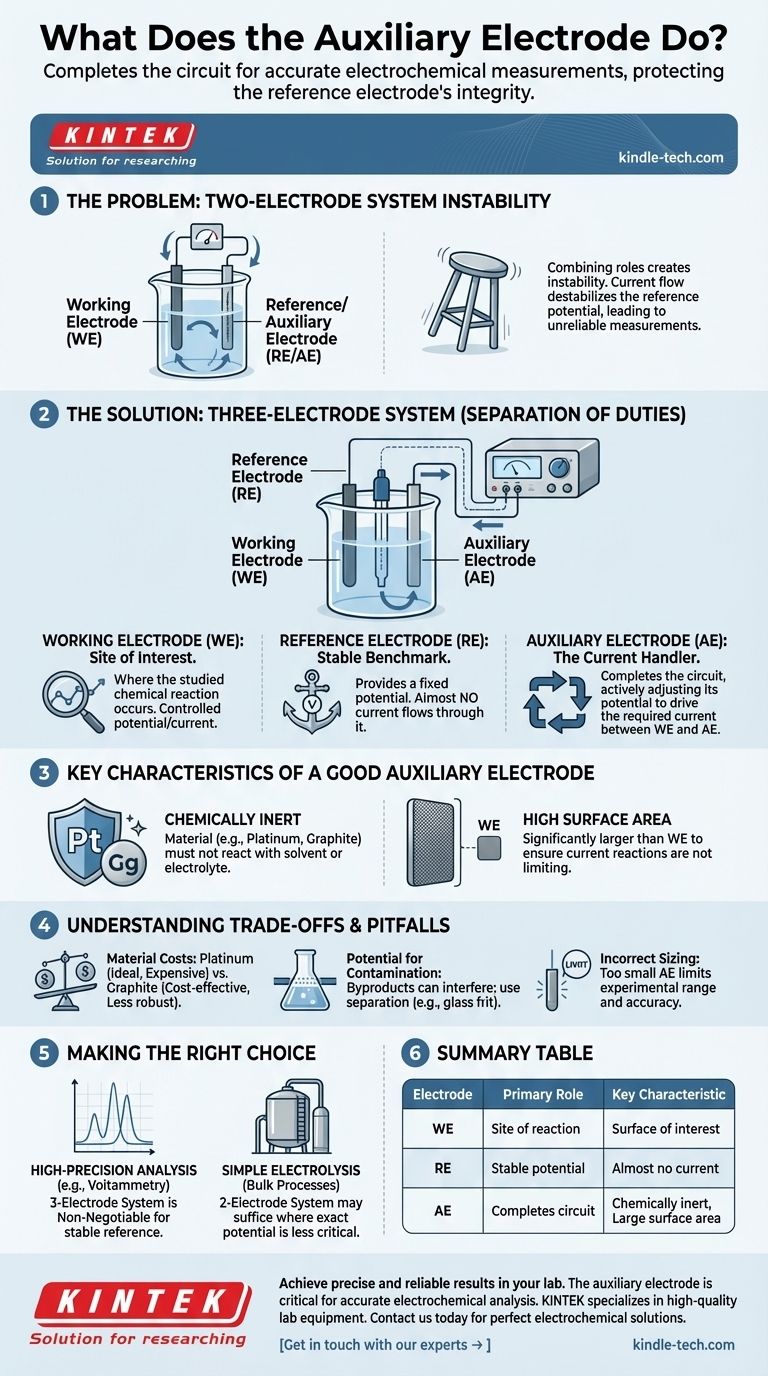
Le problème du système à deux électrodes
Pour comprendre pourquoi une électrode auxiliaire est nécessaire, nous devons d'abord examiner les limites d'une configuration plus simple. Dans de nombreuses situations, un système à deux électrodes est insuffisant pour un contrôle et une mesure précis.
La combinaison des rôles crée une instabilité
Dans une cellule à deux électrodes, vous n'avez qu'une électrode de travail et une seconde électrode forcée d'agir à la fois comme référence (le point stable par rapport auquel le potentiel est mesuré) et comme auxiliaire (le chemin du courant).
L'impact du flux de courant
Le potentiel d'une électrode de référence n'est stable que lorsqu'aucun courant significatif ne la traverse. La forcer à servir également de contre-électrode porteuse de courant déstabilise son potentiel. Il devient alors impossible de connaître le véritable potentiel de votre électrode de travail, rendant vos mesures peu fiables.
La solution à trois électrodes : une séparation des tâches
L'introduction d'une troisième électrode — l'électrode auxiliaire — résout ce problème en créant une séparation claire des rôles au sein de la cellule électrochimique. Cette configuration, gérée par un instrument appelé potentiostat, est la norme pour l'électroanalyse moderne.
L'électrode de travail (ET) : le site d'intérêt
C'est là que se produit la réaction chimique que vous souhaitez étudier. Votre expérience entière est conçue pour contrôler et mesurer le potentiel et/ou le courant à cette surface.
L'électrode de référence (ER) : la référence stable
Le seul travail de l'électrode de référence est de fournir un potentiel fixe et connu. Le potentiostat mesure la différence de potentiel entre l'électrode de travail et l'électrode de référence. Il est crucial que presque aucun courant ne traverse l'ER, préservant ainsi sa stabilité.
L'électrode auxiliaire (EA) : le gestionnaire de courant
L'électrode auxiliaire complète le circuit. Le potentiostat applique un courant entre l'électrode de travail et l'électrode auxiliaire. Le potentiel de l'EA est ajusté activement par l'instrument à la tension nécessaire pour équilibrer la réaction à l'ET et permettre au courant cible de circuler. Elle absorbe efficacement le stress électrique du système.
Caractéristiques clés d'une bonne électrode auxiliaire
Pour remplir efficacement son rôle, une électrode auxiliaire doit posséder des propriétés spécifiques qui l'empêchent d'interférer avec la mesure ou de limiter l'expérience.
Chimiquement inerte
L'électrode auxiliaire doit être fabriquée à partir d'un matériau, comme le platine ou le graphite, qui ne réagira pas avec votre solvant ou votre électrolyte. Son seul travail est de faciliter le transfert d'électrons, pas de faire partie de la chimie que vous étudiez.
Grande surface
La surface de l'électrode auxiliaire doit être nettement supérieure à celle de l'électrode de travail. Cela garantit que les réactions se produisant à la surface auxiliaire peuvent facilement suivre les exigences de courant de l'électrode de travail, empêchant l'EA de devenir le facteur limitant de votre expérience.
Comprendre les compromis et les pièges
Bien qu'essentielle, l'électrode auxiliaire n'est pas un composant que l'on peut oublier. Un choix et un positionnement appropriés sont essentiels pour obtenir de bonnes données.
Coûts des matériaux
Le platine est un matériau idéal en raison de son inertie et de son efficacité, mais il est coûteux. Le graphite est une alternative courante et économique, mais il peut être moins robuste et sa surface peut changer avec le temps.
Potentiel de contamination
Les réactions se produisant à l'électrode auxiliaire (souvent l'oxydation ou la réduction du solvant) produisent des sous-produits chimiques. Dans une cellule mal conçue, ces produits peuvent diffuser vers l'électrode de travail et interférer avec votre réaction d'intérêt. C'est pourquoi la séparation, parfois avec une fritte de verre, est importante.
Dimensionnement incorrect
Utiliser une électrode auxiliaire trop petite est une erreur courante. Si sa surface est insuffisante, elle ne peut pas faire passer le courant requis efficacement. Cela limitera la plage expérimentale et peut entraîner des résultats inexacts, car l'instrument peine à maintenir le potentiel cible à l'électrode de travail.
Faire le bon choix pour votre objectif
La nécessité d'une électrode auxiliaire est directement liée à la nécessité d'un contrôle précis du potentiel.
- Si votre objectif principal est l'analyse de haute précision (par exemple, la voltampérométrie) : Un système à trois électrodes avec une électrode auxiliaire distincte et inerte est non négociable pour obtenir un potentiel de référence stable.
- Si votre objectif principal est l'électrolyse simple ou les processus en vrac : Un système à deux électrodes peut suffire lorsque le potentiel exact est moins critique que la conduite de la réaction globale avec un courant important.
- Si vous concevez une nouvelle expérience : Optez toujours par défaut pour une configuration à trois électrodes. L'utilisation d'une électrode auxiliaire correctement dimensionnée garantit que les données que vous collectez sont un véritable reflet de la chimie se produisant à votre électrode de travail.
En fin de compte, l'électrode auxiliaire est le héros méconnu qui permet un contrôle électrochimique précis et reproductible.
Tableau récapitulatif :
| Électrode | Rôle principal | Caractéristique clé |
|---|---|---|
| Électrode de travail (ET) | Site de la réaction chimique étudiée. | La surface d'intérêt pour l'expérience. |
| Électrode de référence (ER) | Fournit un potentiel fixe et connu pour la mesure. | Presque aucun courant ne la traverse. |
| Électrode auxiliaire (EA) | Complète le circuit électrique en gérant le flux de courant. | Chimiquement inerte (ex. : Platine) et possède une grande surface. |
Obtenez des résultats précis et fiables dans votre laboratoire. L'électrode auxiliaire est essentielle pour une analyse électrochimique précise. Pour que vos recherches soient dignes de confiance, vous avez besoin du bon équipement.
KINTEK est spécialisée dans les équipements et consommables de laboratoire de haute qualité, y compris les cellules et composants électrochimiques. Nous fournissons les outils fiables dont votre laboratoire a besoin pour garantir l'intégrité des mesures et le succès de l'expérience.
Contactez-nous dès aujourd'hui pour trouver les solutions électrochimiques parfaites pour votre application spécifique. Contactez nos experts →
Guide Visuel
Produits associés
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule à flux personnalisable pour la réduction du CO2 pour la recherche sur le NRR, l'ORR et le CO2RR
- Cellules d'électrolyse PEM personnalisables pour diverses applications de recherche
- Boîtier de pile bouton pour applications de laboratoire de piles
Les gens demandent aussi
- Quels avantages les cellules électrolytiques à flux offrent-elles par rapport aux cellules de type H ? Optimiser l'efficacité de l'électrolyse du CO2
- Quel est le but de l'utilisation d'un tube en verre fritté dans une cellule à trois électrodes ? Améliorer la précision des tests d'oxydoréduction du vanadium
- Quelles précautions prendre concernant la température lors de l'utilisation d'une cellule électrolytique entièrement en PTFE ? Assurez des expériences sûres et précises
- Quelles sont les fonctions principales d'une cellule électrolytique haute performance dans le processus eCO2R ? Optimisez les résultats de votre laboratoire
- Quel est le but de la structure à double paroi dans la cellule électrolytique de type H ? Atteindre un contrôle thermique précis


















