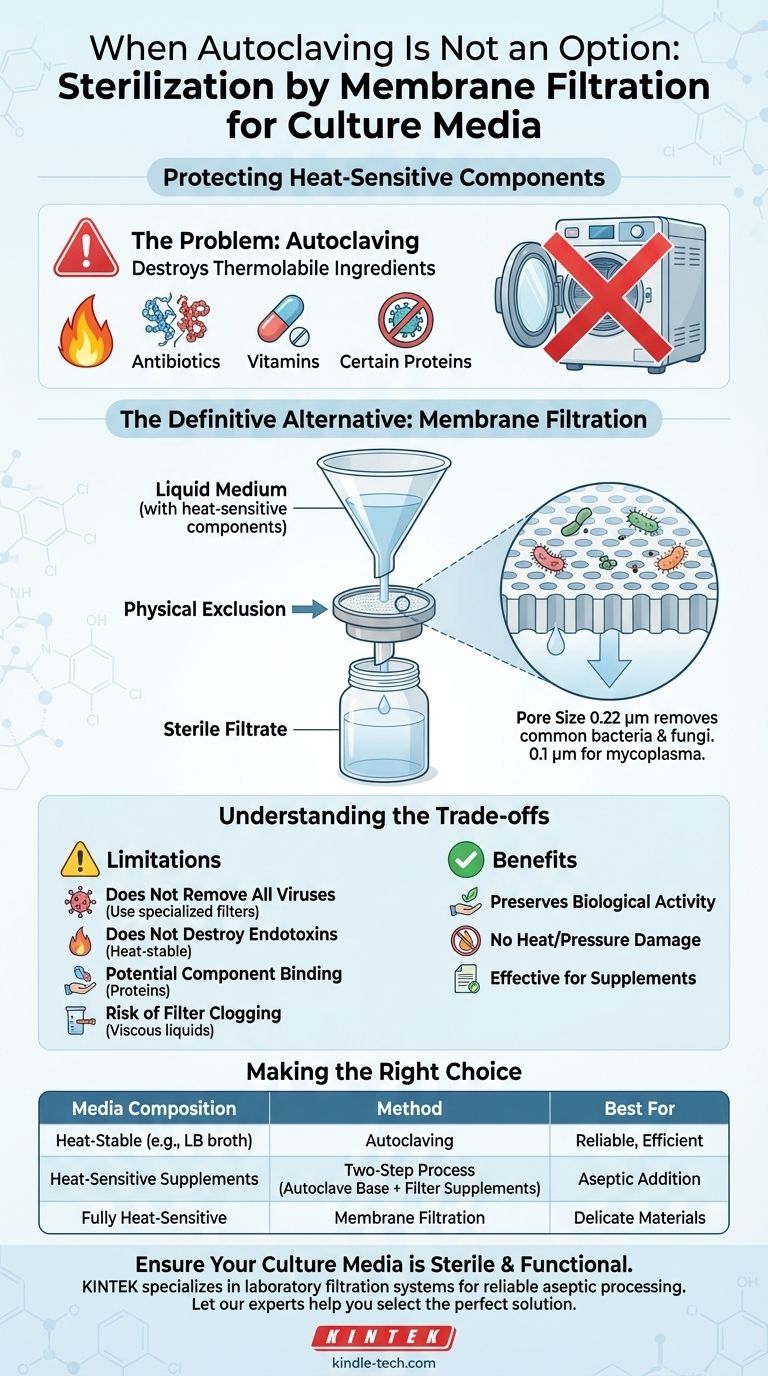
Pour les milieux de culture contenant des composants sensibles à la chaleur, l'alternative définitive à l'autoclavage est la stérilisation par filtration membranaire. Cette méthode d'élimination physique garantit que les ingrédients vitaux et thermolabiles tels que les antibiotiques, les vitamines ou certaines protéines ne sont pas dégradés par les températures et pressions élevées d'un autoclave. Elle élimine efficacement les micro-organismes tout en préservant l'activité biologique souhaitée du milieu.
Le principe fondamental est simple : l'autoclavage tue les microbes par la chaleur, ce qui peut détruire les composants délicats de votre milieu. La filtration élimine physiquement les microbes en faisant passer le liquide à travers un tamis microscopique, préservant ainsi l'intégrité de la solution finale.

Pourquoi l'autoclavage n'est pas toujours la solution
Bien que l'autoclavage soit la référence pour la stérilisation de nombreux matériaux, il repose sur une chaleur intense (généralement 121°C) et une pression. Ce processus est destructeur par conception et ne convient pas à certains composés chimiques.
Le problème des composants sensibles à la chaleur
De nombreux milieux de culture spécialisés nécessitent des suppléments qui sont thermolabiles, ce qui signifie qu'ils se décomposent ou deviennent inactifs lorsqu'ils sont exposés à des températures élevées.
Comme mentionné, des substances telles que l'urée, certains sérums et certaines protéines se dégradent dans les conditions d'autoclavage. D'autres additifs courants sensibles à la chaleur comprennent la plupart des antibiotiques, des vitamines spécifiques et divers facteurs de croissance.
Le risque de dégradation chimique
L'autoclavage de ces composants ne fait pas que les endommager : il peut modifier fondamentalement les propriétés de votre milieu de culture.
Par exemple, si un antibiotique dans un milieu sélectif est détruit, le milieu perd son pouvoir sélectif, permettant la croissance d'organismes indésirables. De même, les facteurs de croissance dégradés ne parviendront pas à soutenir les cultures cellulaires visées.
Le principe de la stérilisation par filtration
La filtration n'est pas une méthode pour tuer les micro-organismes ; c'est une méthode d'exclusion physique. Le processus est simple mais nécessite une attention méticuleuse à la technique aseptique.
Comment fonctionne la filtration membranaire
Le milieu liquide est passé à travers une membrane filtrante contenant des pores d'une taille spécifique et uniforme. Les micro-organismes, étant plus grands que les pores, sont piégés à la surface de la membrane.
Le liquide stérile qui traverse — le filtrat — est ensuite recueilli dans un récipient préalablement stérilisé. Cette procédure entière doit être effectuée dans un environnement stérile, tel qu'une hotte à flux laminaire, pour éviter toute recontamination.
Choisir la bonne taille de pore
L'efficacité de la filtration dépend entièrement de l'utilisation de la bonne taille de pore.
La norme industrielle pour la filtration stérilisante est une membrane avec une taille de pore de 0,22 micromètre (µm). C'est suffisamment petit pour éliminer de manière fiable toutes les bactéries et champignons courants. Pour des applications spécifiques nécessitant l'élimination de microbes plus petits comme les mycoplasmes, un filtre de 0,1 µm peut être nécessaire.
Comprendre les compromis et les limites
Bien que la filtration soit essentielle pour les liquides sensibles à la chaleur, elle ne remplace pas universellement l'autoclavage. Elle présente des limites spécifiques que vous devez comprendre.
Elle n'élimine pas tous les virus
De nombreux virus sont plus petits que 0,22 µm et peuvent traverser un filtre stérilisant standard. Si la contamination virale est une préoccupation, d'autres méthodes ou filtres spécialisés peuvent être nécessaires.
Elle ne détruit pas les endotoxines
Les endotoxines bactériennes sont des molécules thermostables libérées par les parois cellulaires des bactéries à Gram négatif. La filtration peut éliminer les bactéries, mais toutes les endotoxines déjà présentes dans la solution traverseront le filtre.
Potentiel de liaison des composants
Certaines molécules, en particulier les protéines, peuvent s'adsorber (adhérer) à la membrane filtrante. Cela peut entraîner une légère réduction de la concentration de ce composant dans le milieu filtré final, ce qui peut être significatif pour les applications très sensibles.
Risque d'obstruction du filtre
Les liquides visqueux ou les milieux contenant une quantité importante de particules peuvent rapidement obstruer la membrane filtrante, ralentissant le processus et pouvant provoquer la rupture du filtre sous pression.
Faire le bon choix pour votre milieu
La méthode de stérilisation correcte dépend entièrement de la composition de votre milieu de culture. L'objectif est d'atteindre la stérilité tout en préservant la fonction biologique du milieu.
- Si votre milieu ne contient que des composants stables à la chaleur (par exemple, les milieux de base comme LB ou TSB) : L'autoclavage reste la méthode de stérilisation la plus fiable, la plus efficace et la plus rentable.
- Si votre milieu nécessite des suppléments sensibles à la chaleur (par exemple, des antibiotiques ou des vitamines) : Utilisez un processus en deux étapes. Autoclaver d'abord le milieu de base stable à la chaleur, le laisser refroidir à une température sûre, puis ajouter aseptiquement les suppléments stérilisés par filtration.
- Si l'ensemble de votre milieu est composé de matériaux délicats et sensibles à la chaleur : La solution finale complète doit être stérilisée par filtration membranaire dans un récipient récepteur stérile.
En fin de compte, le choix de la bonne méthode consiste à comprendre vos composants pour garantir que votre milieu de culture final est à la fois stérile et efficace.
Tableau récapitulatif :
| Méthode de stérilisation | Idéal pour | Limitation clé |
|---|---|---|
| Autoclavage | Milieux stables à la chaleur (ex. bouillon LB) | Dégrade les composants thermolabiles |
| Filtration membranaire | Milieux sensibles à la chaleur (ex. avec antibiotiques) | N'élimine pas les virus ou les endotoxines |
Assurez-vous que votre milieu de culture est à la fois stérile et pleinement fonctionnel. Si votre travail dépend de composants sensibles à la chaleur tels que des antibiotiques, des vitamines ou des protéines, l'équipement de stérilisation approprié est essentiel. KINTEK se spécialise dans les systèmes de filtration de laboratoire et les consommables conçus pour un traitement aseptique fiable. Laissez nos experts vous aider à sélectionner la solution parfaite pour protéger vos précieux milieux. Contactez-nous dès aujourd'hui pour discuter de vos besoins spécifiques !
Guide Visuel
Produits associés
- Autoclave de laboratoire Stérilisateur à levage par vide pulsé
- Autoclave de laboratoire stérilisateur à vide pulsé, stérilisateur à vapeur de bureau
- Autoclave à vapeur haute pression de laboratoire vertical pour service de laboratoire
- Stérilisateur automatique de laboratoire d'affichage numérique portable Autoclave de laboratoire pour la stérilisation sous pression
- Stérilisateur Autoclave Rapide de Laboratoire de Bureau 35L 50L 90L pour Usage en Laboratoire
Les gens demandent aussi
- Qu'est-ce qu'un autoclave de laboratoire ? Votre guide de la stérilisation à la vapeur sous pression
- Comment fonctionne l'autoclave de laboratoire ? Obtenez une stérilisation complète avec de la vapeur à haute pression
- Comment stériliser la verrerie par autoclave ? Maîtrisez le processus en 3 étapes pour une stérilité fiable
- Pourquoi est-il important de stériliser à l'autoclave les réactifs préparés avant de les utiliser ? Assurer la stérilité et des résultats fiables
- Quel est l'usage de l'autoclave en médecine ? Le rôle essentiel de la stérilisation dans la sécurité des patients

















