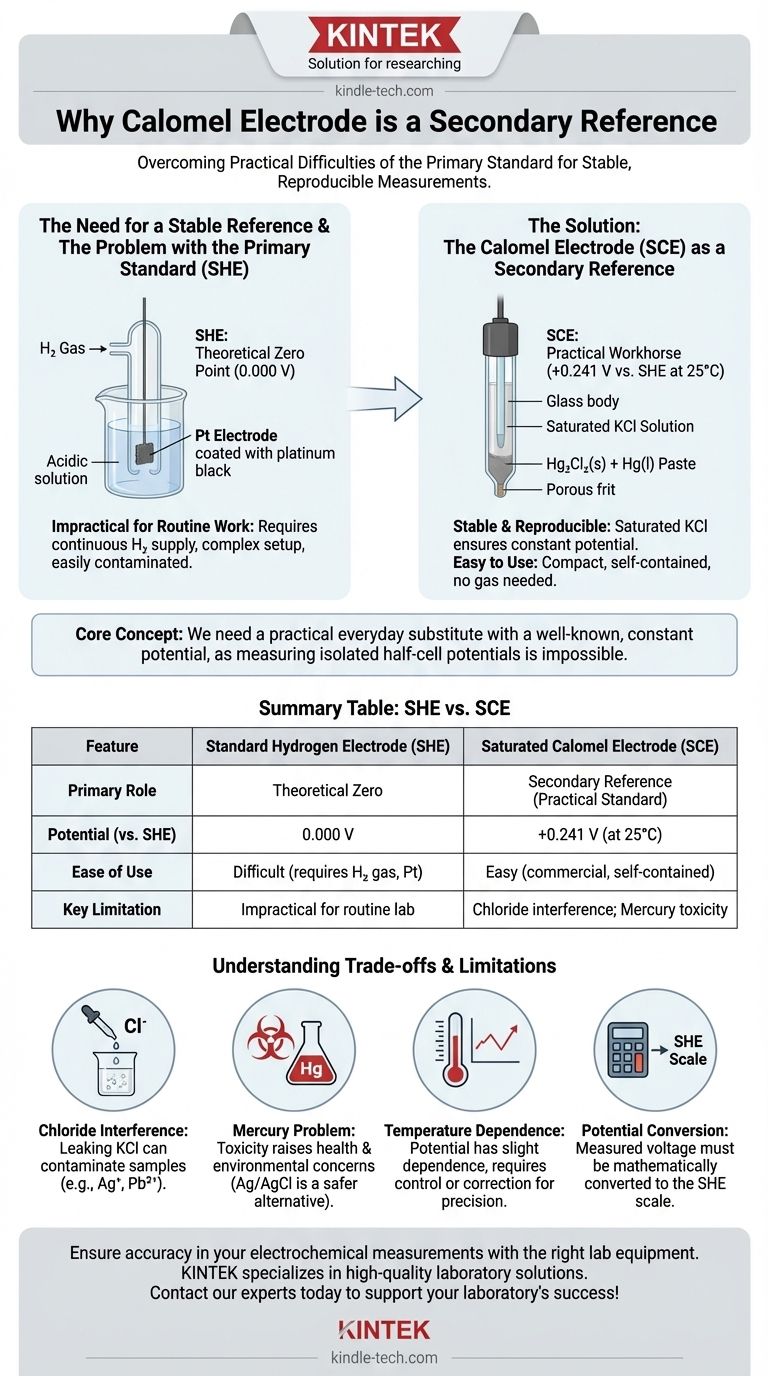
L'électrode au calomel est utilisée comme électrode de référence secondaire car elle fournit un potentiel stable, reproductible et pratique pour la mesure, surmontant les difficultés pratiques importantes liées à l'utilisation de l'étalon primaire, l'Électrode Standard à Hydrogène (EHS).
Le concept fondamental est simple : en électrochimie, vous ne pouvez pas mesurer le potentiel d'une demi-pile isolément. Vous avez besoin d'une base de référence stable. L'Électrode Standard à Hydrogène est la base de référence officielle, mais peu pratique. L'électrode au calomel sert de substitut pratique et quotidien avec un potentiel constant et bien connu.
La nécessité d'une référence stable
Pour comprendre le rôle d'une électrode secondaire, nous devons d'abord comprendre pourquoi une référence est nécessaire.
Le problème du « point zéro »
La tension d'une cellule électrochimique est la différence de potentiel entre deux demi-piles. Il est impossible de mesurer le potentiel absolu d'une seule électrode.
Par conséquent, la communauté scientifique a défini une demi-pile spécifique comme le point zéro universel. Cela permet de mesurer et de rapporter tous les autres potentiels de demi-pile par rapport à un étalon commun.
L'étalon primaire : un idéal peu pratique
L'Électrode Standard à Hydrogène (EHS) est la référence primaire universelle. Par définition, son potentiel est exactement de 0,000 volt dans des conditions standard (activité H+ de 1 M, pression de H₂ gazeux de 1 atm, 25°C).
Cependant, l'EHS est extrêmement difficile à installer et à maintenir. Elle nécessite un approvisionnement continu en gaz hydrogène purifié et une électrode en platine spécialement préparée qui est facilement contaminée, ce qui la rend inappropriée pour la plupart des applications de laboratoire quotidiennes.
L'électrode au calomel : le cheval de trait pratique
Étant donné que l'EHS est si peu pratique, les scientifiques avaient besoin d'une électrode de référence secondaire — une électrode facile à utiliser mais dont le potentiel est précisément connu et constant par rapport à l'EHS. L'Électrode au Calomel Saturée (ECS) est devenue un choix populaire pour ce rôle.
Potentiel stable et reproductible
Le potentiel de l'ECS est basé sur la réaction réversible : Hg₂Cl₂(s) + 2e⁻ ⇌ 2Hg(l) + 2Cl⁻.
Le potentiel de cette électrode dépend de la concentration des ions chlorure (Cl⁻). En utilisant une solution saturée de chlorure de potassium (KCl), la concentration en ions chlorure est maintenue constante et bien définie, ce qui fixe le potentiel de l'électrode à une valeur stable (+0,241 V par rapport à l'EHS à 25°C).
Facilité de construction et d'utilisation
Contrairement à l'EHS, une électrode au calomel est compacte, portable et disponible dans le commerce sous forme d'unité autonome. Elle ne nécessite ni bouteilles de gaz ni préparation complexe, ce qui la rend exceptionnellement pratique pour les mesures de routine.
Comprendre les compromis et les limites
Bien que pratique, l'électrode au calomel n'est pas sans inconvénients, qu'il est essentiel de comprendre pour des mesures précises.
Interférence des ions chlorure
La solution interne de KCl de l'électrode peut fuir lentement à travers le fritté poreux ou le pont salin dans l'échantillon testé. Si l'échantillon contient des ions qui précipitent avec le chlorure (comme l'argent, Ag⁺, ou le plomb, Pb²⁺), cela contaminera l'échantillon et provoquera des lectures erronées.
Le problème du mercure
L'utilisation du mercure (Hg) et de ses sels présente des préoccupations importantes en matière de santé et d'élimination environnementale. En raison de la toxicité du mercure, de nombreux laboratoires ont abandonné les électrodes au calomel au profit des électrodes argent/chlorure d'argent (Ag/AgCl), qui remplissent la même fonction mais sont plus sûres à manipuler.
Dépendance à la température
Le potentiel de l'ECS est stable mais présente une légère dépendance à la température. Pour un travail de haute précision, la température doit être contrôlée, ou un facteur de correction doit être appliqué.
Nécessité de conversion du potentiel
Étant donné que le potentiel de l'électrode au calomel n'est pas nul, toute tension mesurée par rapport à celle-ci doit être convertie mathématiquement à l'échelle de l'EHS pour un rapport standardisé. Pour trouver le potentiel de votre électrode de test par rapport à l'EHS, vous devez ajouter le potentiel de l'électrode au calomel à votre valeur mesurée.
Faire le bon choix pour votre mesure
Choisir et utiliser correctement une électrode de référence est fondamental pour une bonne pratique électrochimique.
- Si votre objectif principal est d'établir un étalon universel : Tous les potentiels finaux rapportés doivent être calculés et présentés par rapport à l'échelle de l'EHS, le point zéro défini de l'électrochimie.
- Si votre objectif principal est l'analyse de laboratoire de routine : Une référence secondaire comme l'électrode au calomel ou Ag/AgCl est le bon choix pour sa commodité, sa stabilité et sa facilité d'entretien.
- Si votre échantillon contient des ions sensibles au chlorure : Vous devez utiliser un système d'électrode de référence sans chlorure, tel qu'une électrode à double jonction, pour éviter les erreurs de mesure causées par la précipitation.
En fin de compte, comprendre le rôle d'une référence secondaire revient à reconnaître la différence entre l'étalon théorique et l'outil pratique nécessaire pour accomplir la tâche.

Tableau récapitulatif :
| Caractéristique | Électrode Standard à Hydrogène (EHS) | Électrode au Calomel Saturée (ECS) |
|---|---|---|
| Rôle principal | Référence primaire (Zéro théorique) | Référence secondaire (Étalon pratique) |
| Potentiel (vs EHS) | 0,000 V | +0,241 V (à 25°C) |
| Facilité d'utilisation | Difficile (nécessite du gaz H₂, électrode Pt) | Facile (commerciale, autonome) |
| Limite clé | Peu pratique pour le travail de laboratoire de routine | Interférence du chlorure ; Toxicité du mercure |
Assurez la précision et la fiabilité de vos mesures électrochimiques avec l'équipement de laboratoire approprié. KINTEK se spécialise dans la fourniture d'équipements et de consommables de laboratoire de haute qualité. Que vous installiez un nouveau laboratoire ou optimisiez vos processus existants, notre expertise peut vous aider à choisir les outils parfaits pour vos besoins. Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir la réussite de votre laboratoire !
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode à disque d'or
- Électrode électrochimique à disque métallique
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
Les gens demandent aussi
- Quand faut-il remplacer un porte-électrode ? Signes critiques pour la sécurité et la qualité de la soudure
- Quelle est la maintenance recommandée pour les électrodes utilisées avec une cellule électrolytique entièrement en PTFE ? Assurer la longévité et la précision des données
- Quel est le rôle commun d'un porte-électrode dans une configuration électrochimique ? C'est l'Électrode de Travail Active
- Comment tester la qualité d'une électrode polie ? Validez les performances avec la voltammétrie cyclique
- Quelles sont les procédures de nettoyage spécifiques pour l'entretien d'un porte-échantillon ? Assurez l'intégrité des données avec un protocole éprouvé
- Pourquoi une électrode à disque-anneau rotatif (RRDE) de haute précision est-elle essentielle pour l'ORR ? Libérez la cinétique catalytique précise
- Quels sont les avantages des électrodes BDD ? Maximiser l'efficacité et la durabilité du traitement des eaux usées
- Quelles sont les caractéristiques clés des feuilles de carbone vitreux RVC ? Libérez une performance électrochimique supérieure

















