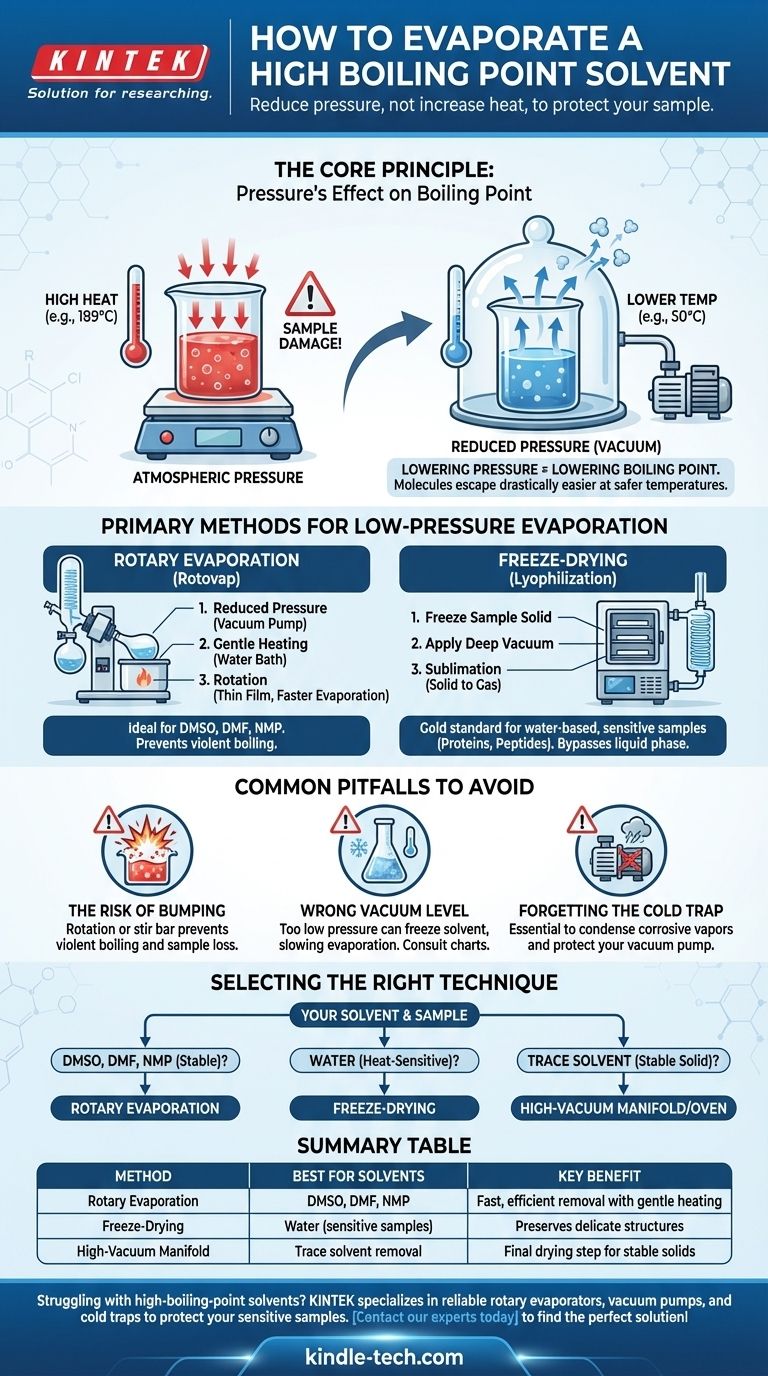
L'évaporation d'un solvant à point d'ébullition élevé est un défi courant en laboratoire où le simple ajout de chaleur est souvent contre-productif et peut détruire votre échantillon. La solution n'est pas de forcer l'évaporation avec des températures élevées, mais de modifier l'environnement en réduisant considérablement la pression. Cela abaisse le point d'ébullition du solvant, lui permettant de se vaporiser doucement et efficacement à une température beaucoup plus sûre et plus basse.
Le principe fondamental est le suivant : au lieu de lutter contre le point d'ébullition élevé du solvant avec une chaleur destructrice, vous modifiez les règles du jeu. En appliquant un vide, vous facilitez considérablement la fuite des molécules de solvant, permettant une évaporation rapide à température ambiante ou proche.

Le Principe Fondamental : L'Effet de la Pression sur le Point d'Ébullition
Pour éliminer efficacement un solvant à point d'ébullition élevé, vous devez d'abord comprendre la physique en jeu. Le processus est entièrement régi par la relation entre la température, la pression et l'état physique du solvant.
Qu'est-ce qui Définit un Point d'Ébullition ?
Un liquide bout à la température à laquelle sa tension de vapeur — la pression exercée par sa forme gazeuse — est égale à la pression de l'environnement qui l'entoure.
Au niveau de la mer, l'eau bout à 100°C car c'est la température à laquelle sa tension de vapeur est égale à la pression atmosphérique standard (~760 torr).
La Relation Pression-Température
L'idée clé est que si vous pouvez abaisser la pression environnementale, vous abaissez également la température requise pour que le solvant bout.
Imaginez que vous retirez un couvercle lourd d'un récipient. Avec moins de pression s'exerçant sur la surface du liquide, ses molécules peuvent s'échapper dans la phase gazeuse beaucoup plus facilement et avec moins d'énergie (chaleur).
Pourquoi Cela Protège Votre Échantillon
De nombreux composés chimiques, en particulier les molécules organiques complexes ou les matériaux biologiques, sont thermiquement sensibles.
Appliquer la chaleur élevée nécessaire pour faire bouillir quelque chose comme le DMSO (point d'ébullition : 189°C) à pression atmosphérique provoquerait presque certainement une décomposition, des réactions secondaires ou une polymérisation, détruisant votre produit final. L'évaporation sous basse pression évite cela complètement.
Principales Méthodes d'Évaporation Sous Basse Pression
Les laboratoires utilisent des équipements spécialisés conçus pour exploiter la relation pression-température. Les deux méthodes les plus courantes sont l'évaporation rotative et la lyophilisation.
L'Évaporateur Rotatif ("Rotovap")
Un évaporateur rotatif est le cheval de bataille le plus courant pour cette tâche. Il élimine efficacement les solvants en combinant trois actions simultanément.
- Pression Réduite : Une pompe à vide abaisse la pression à l'intérieur du système.
- Chauffage Doux : Un bain-marie fournit un niveau de chaleur contrôlé et faible au ballon.
- Rotation : La rotation du ballon étale l'échantillon en un film mince, augmentant considérablement la surface pour une évaporation plus rapide et empêchant l'ébullition violente (projection).
Cette méthode est idéale pour éliminer les solvants organiques courants à point d'ébullition élevé tels que le DMSO, le DMF et le NMP.
Séchage par Congélation (Lyophilisation)
Pour les échantillons les plus sensibles, en particulier ceux dans l'eau, le séchage par congélation est la référence absolue. Ce processus contourne complètement la phase liquide.
D'abord, l'échantillon est congelé à l'état solide. Ensuite, un vide très profond est appliqué. Dans ces conditions, le solvant congelé sublime — passant directement de l'état solide à l'état gazeux — qui est ensuite capturé par un condenseur extrêmement froid.
Cette technique est essentielle pour préserver la structure de matériaux délicats comme les protéines, les peptides et les nanoparticules qui seraient endommagés par n'importe quelle quantité de chaleur ou le stress physique de l'évaporation conventionnelle.
Pièges Courants à Éviter
Bien que puissantes, ces techniques nécessitent une exécution appropriée pour être efficaces et sûres. Comprendre les problèmes potentiels est essentiel pour réussir.
Le Risque de "Projection" (Bumping)
Sous vide, un liquide peut parfois surchauffer et bouillir de manière explosive dans un phénomène appelé projection (bumping). Cela peut vous faire perdre une partie importante de votre échantillon dans le condenseur.
La rotation d'un rotovap est la principale défense contre la projection. Pour les systèmes sous vide statiques, l'ajout d'une barre d'agitation peut aider.
Choisir le Bon Niveau de Vide
Plus de vide n'est pas toujours mieux. Si la pression est trop basse, vous pouvez accidentellement congeler votre solvant dans le ballon (un problème courant avec l'eau sur un rotovap), ce qui ralentit considérablement l'évaporation.
Consultez toujours un tableau de tension de vapeur ou un nomogramme pour votre solvant spécifique afin de trouver les réglages optimaux de température et de pression.
Le Piège Froid est Non Négociable
Un piège froid — un condenseur refroidi avec de la glace carbonique/de l'acétone ou de l'azote liquide — doit toujours être placé entre votre appareil et la pompe à vide.
Les vapeurs de solvant sont très corrosives et détruiront l'huile et les composants internes d'une pompe non protégée. Le piège froid condense ces vapeurs en liquide ou en solide, vous évitant une réparation très coûteuse.
Sélectionner la Bonne Technique pour Votre Solvant
Votre choix de méthode dépend entièrement du solvant que vous retirez et de la sensibilité de votre composé.
- Si votre solvant est du DMSO, du DMF ou du NMP : Un évaporateur rotatif connecté à une pompe à vide appropriée et protégé par un piège froid est la méthode standard de l'industrie.
- Si votre solvant est de l'eau et que votre échantillon est très sensible à la chaleur (par exemple, une protéine) : Le séchage par congélation (lyophilisation) est le choix supérieur pour préserver sa structure délicate.
- Si vous retirez des traces finales de solvant d'un solide stable : Un manifold à vide poussé (ligne Schlenk) ou une étuve sous vide peuvent être utilisés pour l'étape de séchage finale après l'élimination en vrac.
Maîtriser le contrôle de la pression est la clé pour isoler efficacement votre composé pur sans compromis.
Tableau Récapitulatif :
| Méthode | Idéal Pour les Solvants | Avantage Clé |
|---|---|---|
| Évaporation Rotative | DMSO, DMF, NMP | Élimination rapide et efficace avec chauffage doux |
| Séchage par Congélation | Eau (pour échantillons sensibles) | Préserve les structures délicates comme les protéines |
| Manifold à Vide Poussé | Élimination des traces de solvant | Étape de séchage finale pour solides stables |
Vous avez des difficultés avec les solvants à point d'ébullition élevé ? KINTEK est spécialisée dans les équipements de laboratoire et les consommables, fournissant des évaporateurs rotatifs, des pompes à vide et des pièges froids fiables pour garantir que vos échantillons sensibles sont protégés pendant l'évaporation. Notre expertise aide les laboratoires comme le vôtre à obtenir des composés purs et intacts efficacement. Contactez nos experts dès aujourd'hui pour trouver la solution d'évaporation parfaite pour vos besoins !
Guide Visuel
Produits associés
- Pompe à vide à eau en circulation pour usage en laboratoire et industriel
- Pompe à vide rotative à palettes de laboratoire pour usage en laboratoire
- Pompe à vide à membrane sans huile pour usage en laboratoire et industriel
- Presse à chaud sous vide hydraulique chauffée électriquement pour laboratoire
- Machine de Moulage à Froid sous Vide pour la Préparation d'Échantillons
Les gens demandent aussi
- À quoi puis-je utiliser une pompe à vide ? Alimenter les processus industriels, de l'emballage à l'automatisation
- Comment fonctionne une pompe à vide à circulation d'eau ? Découvrez le principe efficace du piston liquide
- Quels types de gaz une pompe à vide à circulation d'eau peut-elle gérer ? Gérez en toute sécurité les gaz inflammables, condensables et sales
- Quel est le rôle de la chambre de compression dans une pompe à vide ? Le cœur de la génération de vide
- Comment une pompe à vide à eau circulante est-elle utilisée pour les résidus de production d'hydrogène ? Optimisez votre séparation solide-liquide



















