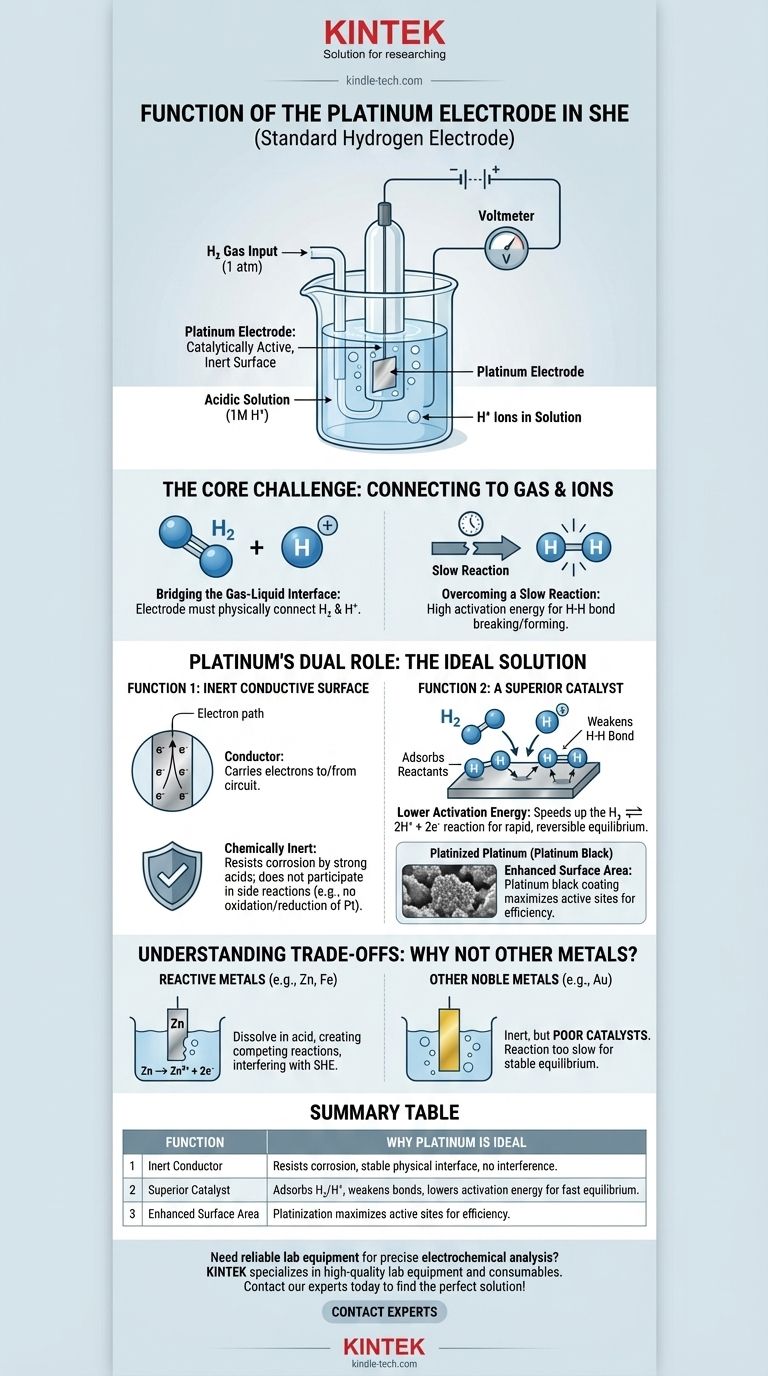
En bref, l'électrode de platine dans une Électrode Standard à Hydrogène (EHN) fonctionne comme une surface inerte catalytiquement active. Elle fournit le site physique où la réaction de l'hydrogène peut se produire et abaisse l'énergie d'activation requise, permettant à la cellule d'atteindre un équilibre stable et mesurable sans que l'électrode elle-même ne soit consommée.
Le défi fondamental de l'EHN est de créer une connexion électrique fiable avec une réaction impliquant un gaz (H₂) et un ion (H⁺). Le platine est particulièrement adapté à ce rôle car il est à la fois un excellent catalyseur pour la réaction de l'hydrogène et un conducteur chimiquement inerte, garantissant qu'il facilite la réaction sans interférer avec elle.

Le Défi Principal : Connecter un Circuit à un Gaz
Pour comprendre la fonction du platine, nous devons d'abord reconnaître le problème fondamental dans la construction d'une Électrode Standard à Hydrogène. L'objectif est de mesurer le potentiel de la réaction redox de l'hydrogène : 2H⁺(aq) + 2e⁻ ⇌ H₂(g).
Combler l'Interface Gaz-Liquide
La réaction implique des ions hydrogène dissous dans une solution acide et du gaz hydrogène barbotant sur l'électrode. Une électrode doit exister physiquement dans cet environnement pour fournir ou accepter des électrons du circuit externe.
Surmonter une Réaction Lente
Cette réaction de l'hydrogène ne se produit pas rapidement ou efficacement d'elle-même. L'énergie nécessaire pour rompre la liaison H-H dans une molécule d'hydrogène ou pour combiner deux ions hydrogène est élevée. Sans aide, le système n'atteindrait pas un équilibre rapide et réversible, le rendant inutile comme référence standard.
Le Double Rôle du Platine : La Solution Idéale
Le platine est choisi car il résout ces deux problèmes simultanément. Il agit à la fois comme conducteur physique inerte et comme catalyseur chimique actif.
Fonction 1 : Une Surface Conductrice Inerte
Premièrement, l'électrode doit être un conducteur pour transporter les électrons vers ou depuis le circuit externe. De manière cruciale, elle doit également être chimiquement inerte.
Elle ne doit pas réagir avec l'acide fort (généralement 1M HCl) ni être oxydée ou réduite elle-même. Le platine est un métal noble, ce qui signifie qu'il est extrêmement résistant à la corrosion et à la dissolution, ce qui en fait la base physique stable parfaite pour l'électrode.
Fonction 2 : Un Catalyseur Supérieur
C'est la fonction la plus critique du platine. Il accélère considérablement la réaction redox de l'hydrogène.
La surface du platine adsorbe à la fois les molécules de gaz hydrogène (H₂) et les ions hydrogène (H⁺). Considérez la surface de platine comme un établi qui maintient les réactifs en place, facilitant leur interaction.
En adsorbant l'hydrogène gazeux, la surface de platine affaiblit la forte liaison covalente H-H, rendant beaucoup plus facile la rupture de la molécule en atomes individuels qui peuvent ensuite être oxydés en ions H⁺. Cette action catalytique est ce qui permet à la réaction de se dérouler rapidement et de manière réversible.
Le Rôle du « Platine Platiné »
Pour maximiser cet effet, l'électrode est souvent recouverte d'une couche de poudre de platine finement divisée, connue sous le nom de noir de platine. Ce processus, appelé platinisation, augmente considérablement la surface active de l'électrode, fournissant beaucoup plus de sites actifs pour la catalyse et assurant que l'électrode fonctionne efficacement.
Comprendre les Compromis : Pourquoi Pas d'Autres Métaux ?
Examiner pourquoi d'autres métaux échouent aide à clarifier pourquoi le platine est le choix définitif.
Le Problème avec les Métaux Réactifs
Les métaux comme le zinc, le fer ou l'aluminium sont très réactifs. S'ils étaient placés dans la solution acide de l'EHN, ils se dissoudraient simplement (Zn → Zn²⁺ + 2e⁻). Cela crée une réaction électrochimique concurrente qui interférerait complètement avec la fonction de l'électrode à hydrogène.
Le Problème avec d'Autres Métaux Nobles
D'autres métaux inertes, comme l'or, pourraient servir de conducteur inerte. Cependant, l'or est un catalyseur nettement moins efficace pour la réaction de l'hydrogène par rapport au platine. Bien qu'une électrode en or ne se corroderait pas, la réaction serait trop lente pour établir un potentiel d'équilibre fiable et reproductible, ce qui irait à l'encontre de l'objectif d'une électrode « standard ».
Faire le Bon Choix pour Votre Objectif
Comprendre la double fonction du platine est essentiel pour saisir les principes fondamentaux de l'électrochimie et des étalons de référence.
- Si votre objectif principal est la cinétique des réactions : Rappelez-vous que le but principal du platine est d'agir comme un catalyseur hétérogène, abaissant l'énergie d'activation pour les réactions d'hydrogène à la fois directe et inverse.
- Si votre objectif principal est la conception de la cellule : Rappelez-vous que le matériau de l'électrode doit être un conducteur inerte qui fournit une interface physique stable sans participer à des réactions secondaires interférant.
Le choix du platine est un choix d'ingénierie délibéré qui permet à l'électrode à hydrogène de servir de point zéro universel pour toutes les mesures électrochimiques.
Tableau Récapitulatif :
| Fonction | Pourquoi le Platine est Idéal |
|---|---|
| Conducteur Inerte | Résiste à la corrosion dans l'acide, fournit une interface physique stable sans réactions interférentes. |
| Catalyseur Supérieur | Adsorbe H₂ et H⁺, affaiblit les liaisons H-H et abaisse l'énergie d'activation pour un équilibre rapide et réversible. |
| Surface Améliorée | La platinisation (revêtement de noir de platine) maximise les sites actifs pour une performance efficace. |
Besoin d'équipement de laboratoire fiable pour une analyse électrochimique précise ? KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, garantissant que votre laboratoire obtient des résultats précis et cohérents. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour vos besoins de recherche !
Guide Visuel
Produits associés
- Électrode en feuille de platine pour applications de laboratoire et industrielles
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode auxiliaire en platine pour usage en laboratoire
- Électrode à disque d'or
Les gens demandent aussi
- Quel est le rôle typique d'une électrode à disque d'or dans une configuration électrochimique ? Votre guide pour une électrode de travail précise
- Pourquoi une électrode auxiliaire en platine (Pt) est-elle nécessaire pour l'analyse de l'acier inoxydable 17-4 PH ? Assurer l'intégrité des données
- Comment l'augmentation de la surface d'un cathode en platine optimise-t-elle la dissolution électrochimique de la cible de molybdène ?
- Quels sont les avantages techniques d'une configuration à trois électrodes en PEC ? Obtenir une caractérisation précise des catalyseurs
- Comment doit-on ranger une brosse en fibre de carbone après le nettoyage ? Préserver la performance et la longévité
- Pourquoi les électrodes en graphite de haute pureté et les creusets en graphite sont-ils utilisés dans les réacteurs à plasma thermique ? Stabilité ultime
- Quelle est la fonction d'un système RDE de laboratoire pour les catalyseurs OER ? Optimiser le criblage de l'activité cinétique
- Quels sont les avantages techniques de l'utilisation d'un fil de platine spiralé comme électrode auxiliaire dans les circuits électrochimiques ?



















