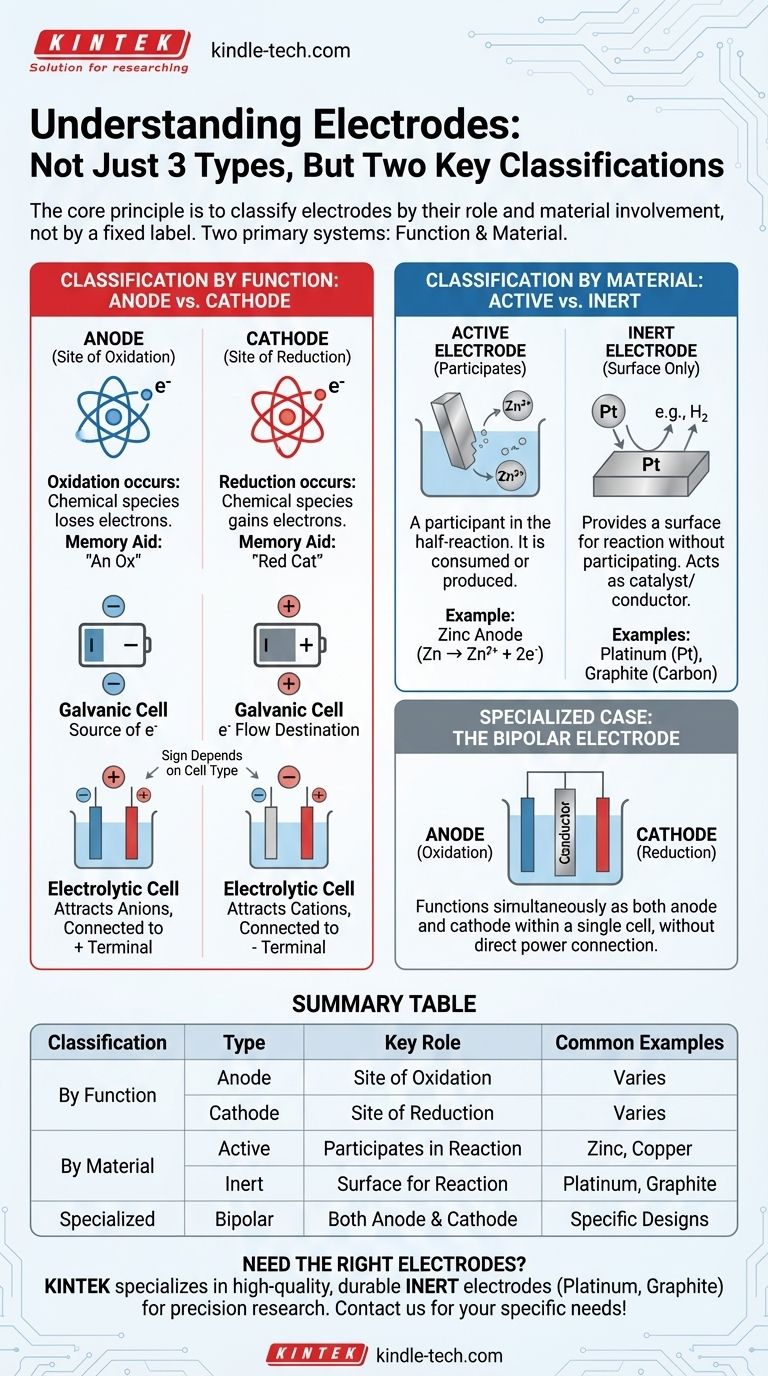
En électrochimie, les électrodes sont mieux comprises non pas comme trois types distincts, mais à travers deux systèmes de classification principaux. Le système le plus fondamental définit une électrode par sa fonction : soit une anode, où l'oxydation a lieu, soit une cathode, où la réduction a lieu. Un deuxième système, tout aussi important, les classe par leur composition matérielle et leur rôle dans la réaction : soit actives (participant à la réaction) soit inertes (fournissant une surface pour la réaction).
Le principe fondamental est de classer les électrodes par leur rôle, et non par une étiquette fixe. Les deux classifications les plus critiques sont basées sur la fonction (Anode vs. Cathode) et l'implication du matériau (Active vs. Inerte). Comprendre ces deux paires est la clé pour analyser toute cellule électrochimique.

Classification par fonction : Anode vs. Cathode
La manière la plus fondamentale de définir une électrode est par le processus chimique qui se produit à sa surface. Ce rôle peut changer en fonction du flux d'électricité.
L'anode : Site d'oxydation
L'anode est définie comme l'électrode où se produit l'oxydation. C'est un processus où une espèce chimique perd des électrons.
Un moyen mnémotechnique simple est "An Ox" (Anode est Oxydation).
La cathode : Site de réduction
La cathode est l'électrode où se produit la réduction. C'est un processus où une espèce chimique gagne des électrons.
Un moyen mnémotechnique correspondant est "Red Cat" (Réduction à la Cathode).
La distinction critique : Signe vs. Fonction
Un point de confusion courant est de savoir si l'anode et la cathode sont positives ou négatives. Cela dépend entièrement du type de cellule électrochimique.
Dans une pile galvanique (comme une batterie)
Une pile galvanique produit de l'électricité à partir d'une réaction spontanée.
- L'anode est la borne négative (-). C'est la source d'électrons provenant de la réaction d'oxydation.
- La cathode est la borne positive (+). C'est là que les électrons circulent pour provoquer la réaction de réduction.
Dans une cellule électrolytique (comme pour le placage)
Une cellule électrolytique utilise de l'électricité externe pour provoquer une réaction non spontanée.
- L'anode est la borne positive (+). Elle est connectée à l'extrémité positive de la source d'alimentation, attirant les anions à oxyder.
- La cathode est la borne négative (-). Elle est connectée à l'extrémité négative de la source d'alimentation, attirant les cations à réduire.
Classification par matériau : Active vs. Inerte
La deuxième classification majeure décrit si le matériau de l'électrode fait lui-même partie de la réaction chimique.
Électrodes actives
Une électrode active (ou électrode réactive) participe à la demi-réaction. Elle est faite d'un matériau qui est soit oxydé, soit le produit d'une réduction.
Par exemple, dans une batterie zinc-cuivre, l'anode de zinc se dissout physiquement (s'oxyde) en ions zinc (Zn → Zn²⁺ + 2e⁻). L'électrode elle-même est consommée.
Électrodes inertes
Une électrode inerte fournit simplement une surface pour que l'oxydation ou la réduction se produise sans participer elle-même à la réaction. Elle agit comme un catalyseur et un conducteur électrique.
Les électrodes inertes courantes comprennent le platine (Pt) et le graphite (carbone). Elles sont utilisées lorsque les espèces oxydées ou réduites sont des ions ou des gaz en solution.
Cas spécialisé : L'électrode bipolaire
Une électrode bipolaire est un conducteur spécialisé placé dans une solution électrolytique qui n'est pas directement connectée à la source d'alimentation.
Elle fonctionne simultanément comme une anode du côté faisant face à la cathode principale et comme une cathode du côté faisant face à l'anode principale, permettant une série de réactions au sein d'une seule cellule.
Prendre la bonne décision
Votre compréhension des électrodes doit guider la façon dont vous analysez un système électrochimique. Le "type" d'électrode est défini par son contexte au sein de la cellule.
- Si vous analysez une batterie (pile galvanique) : Identifiez le site d'oxydation comme l'anode négative et le site de réduction comme la cathode positive.
- Si vous analysez un processus électrolytique (par exemple, l'électrodéposition) : Identifiez l'électrode connectée à la borne positive comme l'anode (oxydation) et celle connectée à la borne négative comme la cathode (réduction).
- Lors de la conception d'une expérience : Vous devez décider si vous avez besoin d'une électrode active qui participe à la réaction ou d'une électrode inerte pour simplement faciliter une réaction entre les espèces déjà présentes dans la solution.
En vous concentrant sur la fonction et l'implication du matériau, vous pouvez décrire et prédire avec précision le comportement de toute électrode dans tout système électrochimique.
Tableau récapitulatif :
| Classification | Type | Rôle clé | Exemples courants |
|---|---|---|---|
| Par fonction | Anode | Site d'oxydation (perd des électrons) | Varie selon le type de cellule |
| Cathode | Site de réduction (gagne des électrons) | Varie selon le type de cellule | |
| Par matériau | Active | Participe à la réaction | Zinc, Cuivre |
| Inerte | Fournit une surface pour la réaction (non réactive) | Platine, Graphite | |
| Spécialisée | Bipolaire | Fonctionne à la fois comme anode et cathode | Utilisée dans des conceptions de cellules spécifiques |
Besoin des bonnes électrodes pour votre application électrochimique ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité, y compris les électrodes inertes durables en platine et en graphite, conçues pour la précision et la fiabilité dans votre laboratoire. Laissez nos experts vous aider à sélectionner les composants parfaits pour votre recherche ou votre processus. Contactez-nous dès aujourd'hui pour discuter de vos besoins spécifiques !
Guide Visuel
Produits associés
- Électrode Électrochimique en Feuille d'Or Électrode en Or
- Électrode électrochimique à disque métallique
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode à disque d'or
Les gens demandent aussi
- Pourquoi les tiges en titane sont-elles utilisées dans la construction des électrodes MEC ? Assurer une conductivité élevée et une résistance à la corrosion
- Quelle est la fonction d'un pont salin dans les expériences électrochimiques ? Maintenir la neutralité de la cellule pour des réactions continues
- Quelles sont les caractéristiques d'une électrode argent/chlorure d'argent pour les solutions neutres ? Obtenez des mesures stables et précises
- Quel est le rôle de l'électrode auxiliaire ? Assurer des mesures électrochimiques précises
- Pourquoi le platine (Pt) est-il utilisé comme électrode auxiliaire pour la corrosion des alliages à haute entropie (HEA) ? Assurer une isolation et une précision du signal précises
- Quels avantages techniques les électrodes en graphite de carbone offrent-elles aux biofilms électroactifs ? Optimisez votre bio-recherche
- Pourquoi une électrode de référence à double jonction est-elle recommandée pour le dichlorométhane ? Assurer la stabilité dans les phases non aqueuses
- Quelle est la forme et la taille typiques d'une électrode à disque métallique ? Un guide des dimensions standard et personnalisées



















