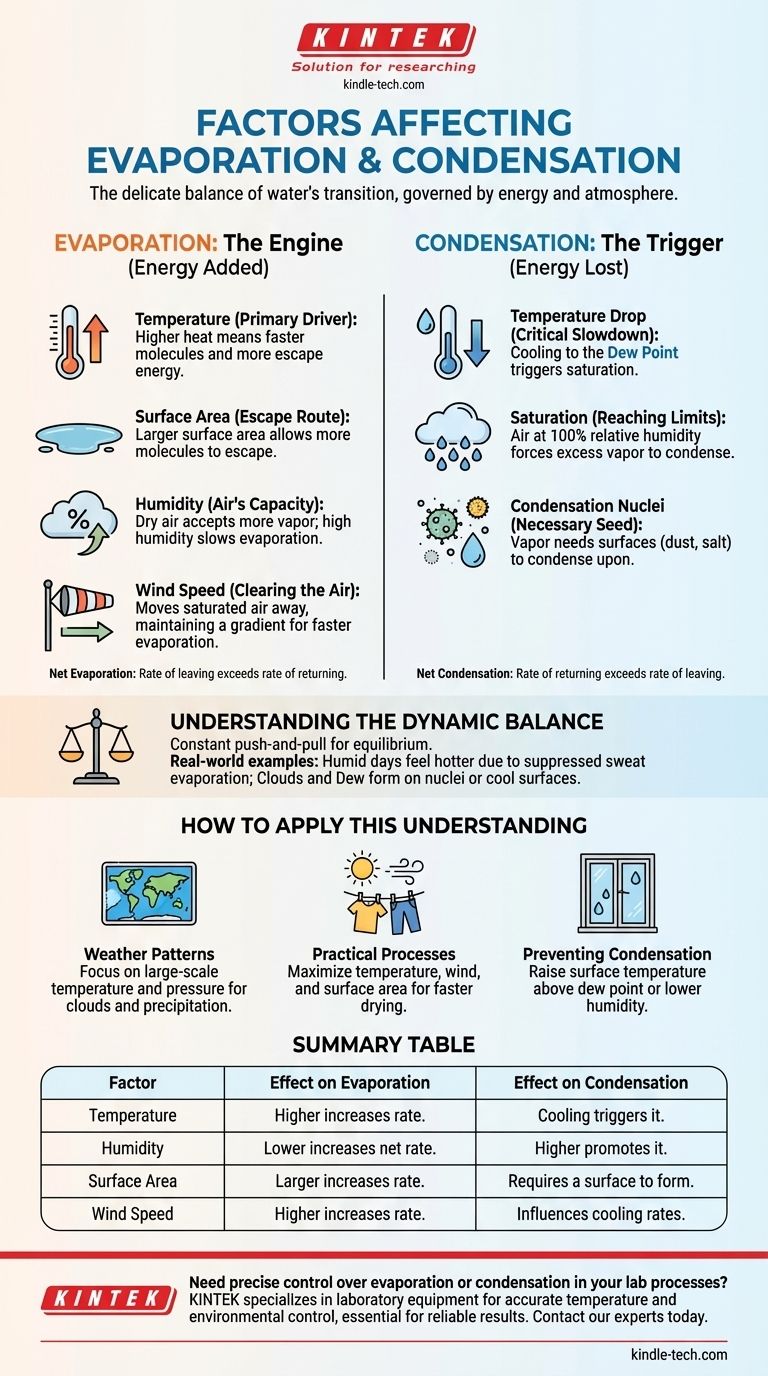
La transition de l'eau entre l'état liquide et gazeux est régie par un équilibre délicat entre l'énergie et les conditions atmosphériques. Pour l'évaporation, les facteurs clés sont la température, la surface, l'humidité et la vitesse du vent. Pour la condensation, les facteurs critiques sont une baisse de température jusqu'au point de rosée, la quantité de vapeur d'eau déjà présente dans l'air et la présence de surfaces appelées noyaux de condensation.
L'évaporation est fondamentalement un processus alimenté par l'énergie qui permet à l'eau de s'échapper, tandis que la condensation est la libération de cette énergie lorsque l'eau redevient liquide. Comprendre cet échange d'énergie est la clé pour comprendre pourquoi et quand chaque processus se produit.

Le moteur de l'évaporation : ajout d'énergie et d'espace
L'évaporation est le processus par lequel l'eau liquide absorbe suffisamment d'énergie pour se transformer en état gazeux, ou vapeur d'eau. La vitesse à laquelle cela se produit est contrôlée par plusieurs facteurs interconnectés.
Température : le moteur principal
La chaleur est une forme d'énergie. Lorsque la température de l'eau augmente, ses molécules se déplacent plus rapidement et avec plus d'énergie.
Cette énergie cinétique accrue permet à davantage de molécules de vaincre les liaisons qui les maintiennent ensemble à l'état liquide et de s'échapper de la surface vers l'air sous forme de vapeur.
Surface : la voie d'évacuation
L'évaporation ne se produit qu'à la surface d'un liquide. Plus la surface exposée à l'air est grande, plus il y a de molécules en position de s'échapper.
C'est pourquoi une flaque d'eau étalée sur le trottoir s'évapore beaucoup plus rapidement que la même quantité d'eau dans un verre profond.
Humidité : la capacité de l'air à contenir de l'eau
L'humidité relative mesure la quantité de vapeur d'eau actuellement présente dans l'air par rapport à la quantité maximale qu'il pourrait contenir à cette température.
Si l'air est déjà saturé d'eau (100 % d'humidité relative), il y a peu de « place » pour plus de vapeur. Cela ralentit considérablement le taux d'évaporation nette. L'air sec, en revanche, accepte facilement plus de vapeur d'eau.
Vitesse du vent : dégager l'air
Lorsque l'eau s'évapore, elle crée une fine couche d'air humide directement au-dessus de la surface de l'eau. Cela peut ralentir l'évaporation ultérieure.
Le vent agit pour souffler cette couche saturée, la remplaçant par de l'air plus sec. Cela maintient un gradient de concentration abrupt, favorisant un taux d'évaporation plus rapide et plus continu.
Le déclencheur de la condensation : perte d'énergie et recherche d'une surface
La condensation est le processus inverse de l'évaporation. Elle se produit lorsque la vapeur d'eau dans l'air se refroidit et redevient de l'eau liquide, libérant l'énergie qu'elle avait absorbée pendant l'évaporation.
Baisse de température : le ralentissement critique
Pour que la condensation se produise, l'air doit se refroidir jusqu'à son point de rosée. C'est la température à laquelle l'air devient entièrement saturé de la vapeur d'eau qu'il contient.
Lorsque l'air se refroidit, ses molécules ralentissent. Une fois qu'elles ralentissent suffisamment, les faibles attractions entre elles peuvent les rassembler en gouttelettes liquides.
Le rôle de la saturation
La condensation est un résultat direct de l'air atteignant 100 % d'humidité relative. À ce stade, l'air ne peut tout simplement plus contenir d'eau sous forme gazeuse à sa température actuelle.
Tout refroidissement supplémentaire, ou l'ajout de plus de vapeur d'eau, forcera une partie de cette vapeur à se condenser en liquide.
Noyaux de condensation : une graine nécessaire
La vapeur d'eau a besoin d'une surface non gazeuse sur laquelle se condenser. Dans l'atmosphère, ce sont des particules microscopiques de poussière, de sel, de pollen ou de polluants.
Ces particules sont appelées noyaux de condensation, et elles servent de « graines » autour desquelles se forment les gouttelettes de nuages. Au sol, la condensation se forme sous forme de rosée sur des surfaces plus grandes comme l'herbe, les fenêtres ou une canette de soda froide qui s'est refroidie en dessous du point de rosée de l'air ambiant.
Comprendre l'équilibre dynamique
L'évaporation et la condensation ne sont pas des événements isolés. Elles sont dans un jeu constant de va-et-vient, cherchant l'équilibre. Reconnaître leur interaction est crucial pour comprendre les phénomènes du monde réel.
Le concept d'évaporation nette
Même lorsque nous voyons une flaque d'eau rétrécir, une partie de la vapeur d'eau de l'air se condense toujours dans la flaque.
Ce que nous observons comme « évaporation » est en réalité une évaporation nette, ce qui signifie que le taux de molécules quittant le liquide est supérieur au taux de molécules y retournant. L'inverse est vrai pour la condensation nette.
Pourquoi les journées humides semblent plus chaudes
Nos corps se refroidissent en transpirant. L'évaporation de cette sueur élimine la chaleur de notre peau.
Par une journée chaude et humide, la forte concentration de vapeur d'eau dans l'air supprime le taux d'évaporation. Parce que notre sueur ne peut pas s'évaporer efficacement, nous perdons notre principal mécanisme de refroidissement et nous nous sentons plus chaud.
Comment se forment les nuages et la rosée
Ces deux phénomènes illustrent parfaitement les principes de la condensation. Les nuages se forment lorsqu'une masse d'air monte, se dilate et se refroidit jusqu'à son point de rosée en altitude, se condensant sur des noyaux en suspension dans l'air.
La rosée se forme lorsqu'une surface au sol, comme une brins d'herbe, rayonne de la chaleur et se refroidit pendant la nuit en dessous du point de rosée de l'air environnant, provoquant la condensation de la vapeur directement dessus.
Comment appliquer cette compréhension
Votre objectif spécifique déterminera quels facteurs sont les plus importants à considérer.
- Si votre objectif principal concerne les modèles météorologiques : Concentrez-vous sur les changements de température à grande échelle et les systèmes de pression atmosphérique, qui poussent les masses d'air à monter et à se refroidir, provoquant la condensation (nuages et précipitations).
- Si votre objectif principal concerne un processus pratique (comme le séchage du linge) : Vous devez maximiser les facteurs qui accélèrent l'évaporation : augmenter la température (lumière du soleil), augmenter le vent (une brise) et augmenter la surface (étendre les vêtements).
- Si votre objectif principal est d'éviter la condensation indésirable (sur les fenêtres ou les équipements) : Vous devez soit augmenter la température de la surface pour qu'elle reste au-dessus du point de rosée, soit réduire la quantité de vapeur d'eau dans l'air (diminuer l'humidité).
En saisissant ces principes fondamentaux, vous acquérez la capacité de prédire et même de contrôler le comportement de l'eau dans d'innombrables systèmes naturels et artificiels.
Tableau récapitulatif :
| Facteur | Effet sur l'évaporation | Effet sur la condensation |
|---|---|---|
| Température | Une température plus élevée augmente le taux. | Le refroidissement jusqu'au point de rosée déclenche la condensation. |
| Humidité | Une humidité plus faible augmente l'évaporation nette. | Une humidité/saturation plus élevée favorise la condensation. |
| Surface | Une plus grande surface augmente le taux. | Nécessite une surface (ex. : noyaux, herbe) pour se former. |
| Vitesse du vent | Une vitesse plus élevée augmente le taux en éliminant l'air humide. | Impact moins direct, mais peut influencer les taux de refroidissement. |
Besoin d'un contrôle précis de l'évaporation ou de la condensation dans vos processus de laboratoire ? KINTEK est spécialisée dans les équipements et consommables de laboratoire qui offrent le contrôle précis de la température et de l'environnement essentiel pour des résultats fiables. Que vous développiez de nouveaux matériaux ou que vous réalisiez des analyses critiques, nos solutions vous aident à maîtriser ces changements de phase fondamentaux. Contactez nos experts dès aujourd'hui pour trouver l'équipement adapté à vos besoins spécifiques en laboratoire.
Guide Visuel
Produits associés
- Unité de distillation d'eau murale
- Bateau d'évaporation pour matière organique
- Creuset d'évaporation pour matière organique
- Pompe à vide à circulation d'eau de laboratoire pour usage en laboratoire
- Refroidisseur à piège froid sous vide Refroidisseur à piège froid indirect
Les gens demandent aussi
- Quelle est l'actualité de l'évaporation par faisceau d'électrons ? Un guide pour le dépôt de couches minces de haute pureté
- Quels sont les effets de la température et de la pression sur l'évaporation ? Maîtriser le contrôle pour votre processus
- Quels sont les inconvénients de l'évaporation thermique ? Comprendre les limites pour les applications haute performance
- Qu'est-ce que le processus d'évaporation des semi-conducteurs ? Un guide pour le dépôt de couches minces de haute pureté
- Quel est l'avantage de l'évaporation thermique par rapport à la pulvérisation cathodique ? Dépôt de couches minces plus rapide et plus rentable
- Que devient l'or lorsqu'il s'évapore ? Il devient un gaz monoatomique pour les technologies avancées
- Comment fonctionne l'évaporation par faisceau d'électrons ? Un guide du dépôt de couches minces de haute pureté
- Qu'est-ce que la technique d'évaporation sous vide pour les couches minces ? Un guide pour le dépôt de couches minces de haute pureté




