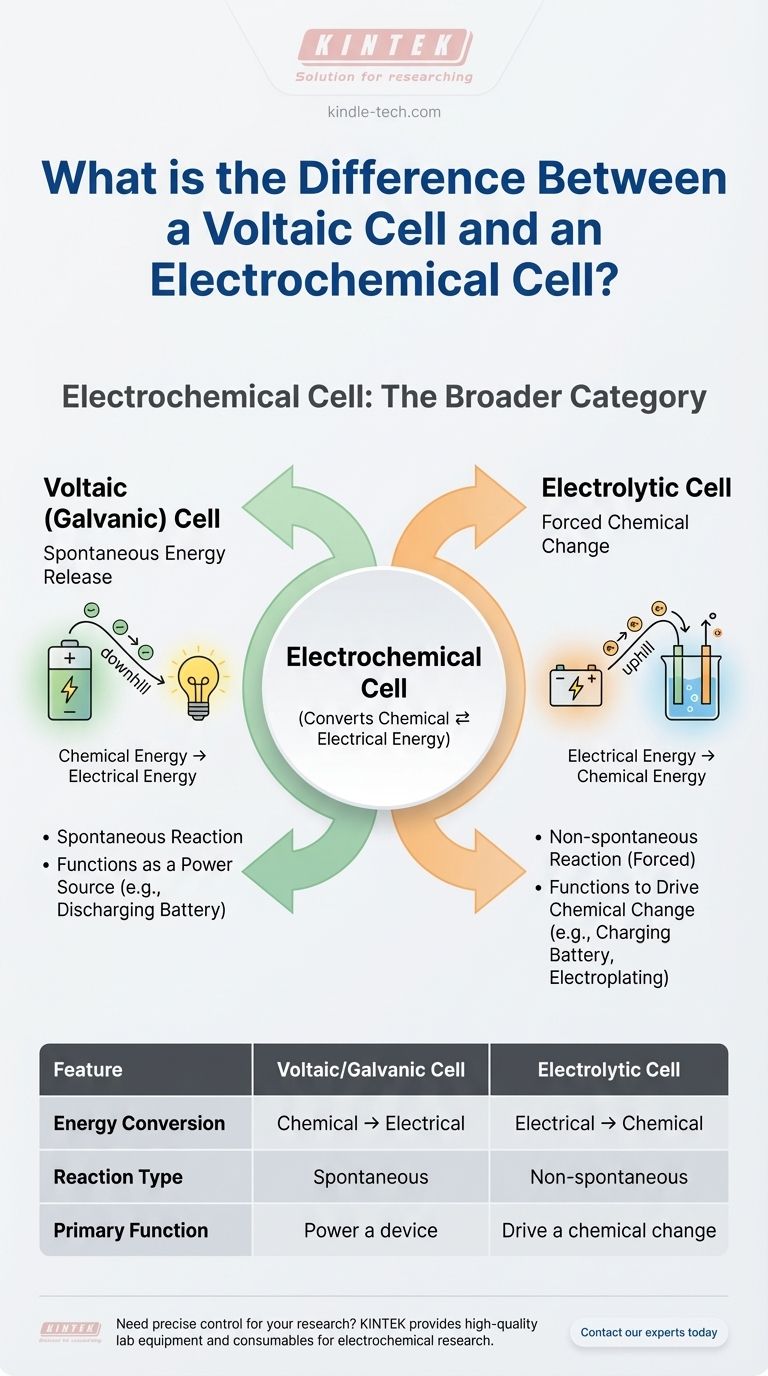
Pour être direct, une pile voltaïque n'est pas différente d'une pile électrochimique — c'est un type de pile électrochimique. Le terme "pile électrochimique" est la catégorie générale pour tout dispositif qui convertit l'énergie chimique en énergie électrique ou vice versa. Une pile voltaïque, également connue sous le nom de pile galvanique, est le type spécifique qui génère spontanément de l'électricité à partir d'une réaction chimique.
Le malentendu fondamental vient du fait de traiter ces termes comme des choix parallèles. Au lieu de cela, pensez-y comme une hiérarchie : la "Pile Électrochimique" est le nom de famille, et elle a deux enfants : la Pile Voltaïque (qui produit de l'énergie) et la Pile Électrolytique (qui consomme de l'énergie).

Les deux voies de l'électrochimie
Une pile électrochimique est fondamentalement un pont entre les mondes chimique et électrique. Toutes ces piles partagent des composants de base — deux électrodes (une anode et une cathode) et un électrolyte qui permet aux ions de se déplacer entre elles.
La différence cruciale réside dans la direction de la conversion d'énergie.
Type 1 : La pile voltaïque (galvanique) — Libération spontanée d'énergie
Une pile voltaïque exploite une réaction chimique spontanée pour produire de l'énergie électrique.
Pensez-y comme une glissade contrôlée. Les produits chimiques sont naturellement "en descente" en termes d'énergie, et la pile voltaïque fournit un chemin pour que cette énergie soit libérée sous forme de courant électrique utile.
C'est le principe derrière une pile courante. Les réactions chimiques à l'intérieur d'une pile AA veulent se produire d'elles-mêmes, et lorsque vous complétez le circuit, la pile canalise le flux d'électrons résultant pour alimenter votre appareil.
Type 2 : La pile électrolytique — Changement chimique forcé
Une pile électrolytique fait exactement le contraire. Elle utilise une source externe d'énergie électrique pour forcer une réaction chimique qui ne se produirait pas d'elle-même.
C'est le chemin "en montée". Vous injectez de l'énergie dans le système pour créer un état chimique moins stable.
Les exemples classiques incluent l'utilisation de l'électricité pour l'électrolyse (comme la séparation de l'eau en hydrogène et en oxygène) ou la recharge d'une batterie. Lorsque vous chargez votre téléphone, vous faites fonctionner sa batterie comme une pile électrolytique, inversant les réactions chimiques qui se sont produites lorsqu'elle alimentait votre appareil.
Comprendre les différences critiques
La distinction entre ces deux types de piles est le concept le plus important en électrochimie de base. La direction du flux d'énergie dicte la fonction entière de la pile.
Conversion d'énergie
Une pile voltaïque convertit l'énergie chimique en énergie électrique. C'est une source d'énergie.
Une pile électrolytique convertit l'énergie électrique en énergie chimique. C'est un consommateur d'énergie.
Spontanéité de la réaction
La réaction redox dans une pile voltaïque est spontanée. Elle se produit sans intervention externe une fois le circuit fermé.
La réaction redox dans une pile électrolytique est non spontanée. Elle nécessite une alimentation électrique externe (comme une batterie ou une source d'alimentation CC) pour se produire.
Fonction pratique
La fonction d'une pile voltaïque est d'alimenter quelque chose. Pensez à n'importe quelle pile standard non rechargeable.
La fonction d'une pile électrolytique est de produire un changement chimique. Pensez à la galvanoplastie ou à la charge d'une batterie rechargeable.
Comment classer correctement votre pile
Pour appliquer ces connaissances, demandez simplement si la pile produit de l'énergie ou la consomme pour provoquer une réaction.
- Si votre objectif principal est de décrire tout dispositif qui interconvertit l'énergie chimique et électrique : Utilisez le terme général pile électrochimique.
- Si vous décrivez spécifiquement une batterie qui se décharge pour alimenter un appareil : Utilisez les termes spécifiques pile voltaïque ou pile galvanique.
- Si vous décrivez spécifiquement un processus qui utilise l'électricité pour forcer une réaction (comme la charge d'une batterie ou l'électrolyse) : Utilisez le terme spécifique pile électrolytique.
En comprenant cette classification simple, vous pouvez décrire tout processus électrochimique avec précision et clarté.
Tableau récapitulatif :
| Caractéristique | Pile Voltaïque/Galvanique | Pile Électrolytique |
|---|---|---|
| Conversion d'énergie | Chimique → Électrique | Électrique → Chimique |
| Type de réaction | Spontanée | Non spontanée (Forcée) |
| Fonction principale | Alimenter un appareil (ex : batterie) | Provoquer un changement chimique (ex : galvanoplastie) |
Besoin d'un contrôle précis sur vos processus électrochimiques ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité pour tous vos besoins en recherche et développement électrochimiques. Que vous travailliez avec des piles voltaïques, des piles électrolytiques ou toute autre application de laboratoire, nos solutions garantissent précision et fiabilité. Contactez nos experts dès aujourd'hui pour trouver l'équipement parfait pour votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Pourquoi est-il nécessaire d'équiper un système d'électrolyse au sel fondu d'une chemise chauffante en céramique de haute précision ?
- Quel est le principe de l'électrodéposition des métaux ? Un guide pour le revêtement métallique contrôlé
- Comment les potentiomètres ou galvanomètres de haute précision sont-ils utilisés dans la CGDE ? Maîtriser la caractérisation des électrolytes
- Quels sont les avantages de conception d'une cellule à flux à trois chambres ? Maximiser l'efficacité de la réduction du CO2
- Quelle est la fonction d'une cellule électrolytique en acier inoxydable dans les tests ESW ? Assurer une analyse précise des liquides ioniques
- Quelles sont les considérations relatives au courant électrique lors de l'utilisation d'une cellule électrolytique en acrylique ? Gérer la chaleur pour éviter les dommages
- Quelles sont les configurations d'ouverture pour les versions non scellée et scellée de la cellule d'électrolyse ? Optimisez votre montage électrochimique
- Quel est le but de l'utilisation d'un système de cellule électrolytique à trois électrodes ? Criblage de précision pour les électrodes AEMWE



















