Lors du choix d'un électrolyte pour une expérience, vous devez évaluer quatre propriétés clés : sa conductivité ionique, sa fenêtre de stabilité électrochimique, sa solubilité dans le solvant choisi et sa compatibilité chimique avec l'ensemble de votre système expérimental. Ces facteurs déterminent collectivement si l'électrolyte soutiendra la réaction que vous souhaitez étudier ou introduira des artefacts qui invalideront vos résultats.
Le point essentiel à retenir est qu'un électrolyte n'est pas simplement un conducteur passif. C'est un composant chimique actif qui définit les limites de fonctionnement de votre cellule électrochimique et peut participer directement à des réactions secondaires, faisant de sa sélection minutieuse un élément fondamental pour obtenir des données fiables et significatives.

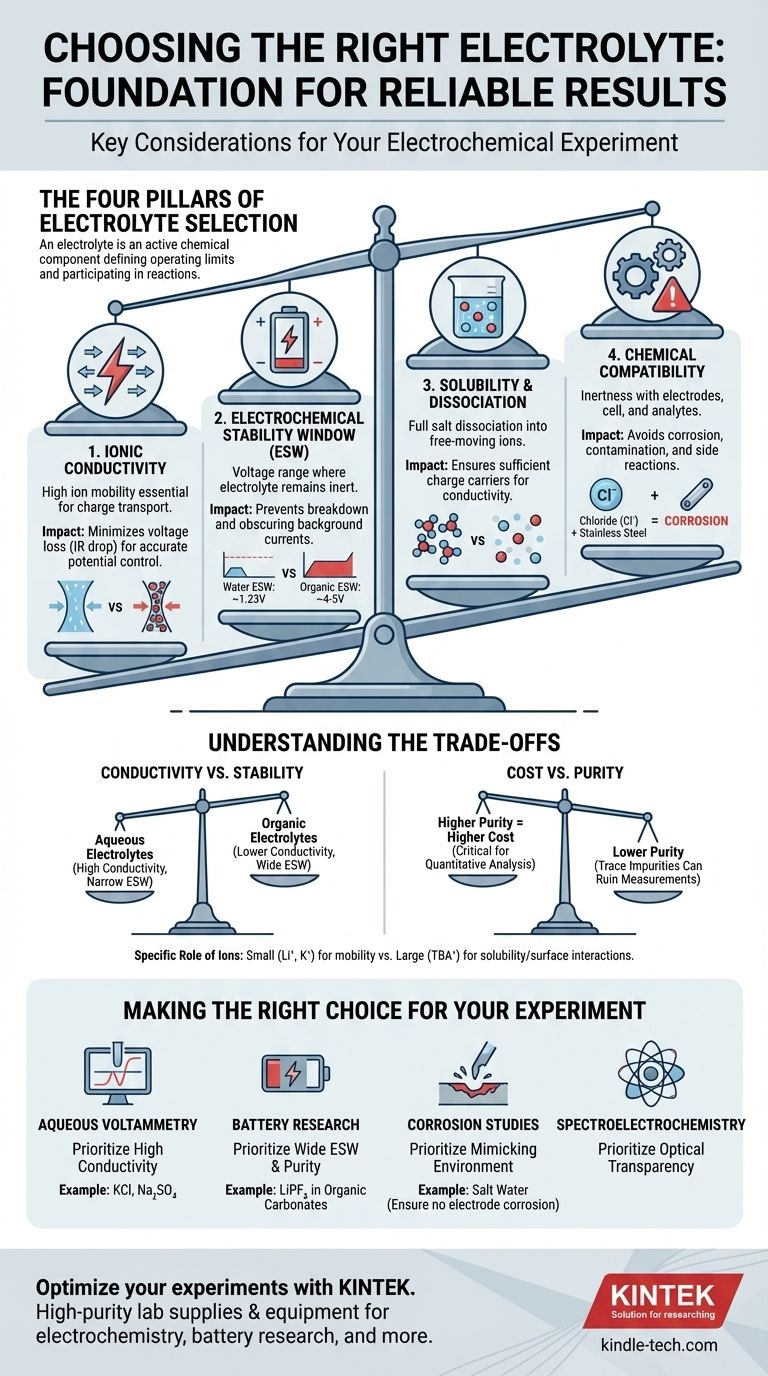
Les Quatre Piliers de la Sélection d'un Électrolyte
Choisir le bon électrolyte est un processus d'équilibrage des exigences. L'électrolyte idéal facilite la réaction souhaitée tout en restant complètement inerte et invisible à la mesure. Nous pouvons décomposer ce processus de sélection en quatre considérations critiques.
Pilier 1 : Conductivité Ionique
Le rôle principal d'un électrolyte est de transporter la charge entre les électrodes. Une conductivité ionique élevée est essentielle à cette fin.
Une mauvaise conductivité entraîne une chute ohmique importante (ou chute IR), qui est une perte de tension à travers l'électrolyte. Cela signifie que le potentiel que vous appliquez à votre cellule n'est pas le potentiel réellement ressenti à la surface de l'électrode, ce qui conduit à des mesures inexactes des potentiels de réaction.
Considérez l'électrolyte comme une autoroute pour les ions. Un électrolyte à haute conductivité est une autoroute large et dégagée, tandis qu'un électrolyte à faible conductivité est une rue latérale congestionnée, ralentissant tout et gaspillant de l'énergie.
Pilier 2 : Fenêtre de Stabilité Électrochimique (FSE)
La fenêtre de stabilité électrochimique (FSE) est la plage de potentiels où l'électrolyte lui-même — le sel et le solvant — n'est ni oxydé ni réduit.
Opérer en dehors de cette fenêtre est une défaillance critique. Si vous appliquez un potentiel trop positif ou trop négatif, vous commencerez à décomposer l'électrolyte au lieu d'étudier votre analyte. Cela crée des courants de fond importants qui peuvent masquer complètement le signal que vous essayez de mesurer.
Par exemple, la FSE de l'eau n'est que d'environ 1,23 V. Pour les expériences nécessitant des potentiels plus élevés, comme dans la recherche sur les batteries lithium-ion, vous devez passer à des solvants organiques et à des sels spécifiques (par exemple, LiPF₆ dans des carbonates organiques) qui offrent une fenêtre beaucoup plus large (~4-5 V).
Pilier 3 : Solubilité et Dissociation
Pour qu'un électrolyte fonctionne, le sel doit non seulement se dissoudre, mais aussi se dissocier complètement en cations et anions libres dans le solvant.
Si le sel a une faible solubilité ou forme des « paires d'ions » serrées au lieu de se séparer, le nombre de porteurs de charge disponibles diminue considérablement. Cela réduit directement la conductivité ionique, sapant la fonction principale de l'électrolyte.
Assurez-vous toujours que le sel choisi est très soluble dans le solvant choisi à la concentration que vous prévoyez d'utiliser (généralement 0,1 M à 1,0 M pour les expériences à l'échelle du laboratoire).
Pilier 4 : Compatibilité Chimique
L'électrolyte doit être chimiquement inerte par rapport à chaque composant de votre cellule : l'électrode de travail, l'électrode auxiliaire, l'électrode de référence et le corps de la cellule lui-même.
Une erreur courante consiste à utiliser un électrolyte contenant des ions chlorure (comme le KCl) avec des composants en acier inoxydable. Le chlorure est très corrosif pour l'acier inoxydable et provoquera une piqûre et libérera des ions métalliques dans votre solution, contaminant l'expérience.
De même, les ions de l'électrolyte ne doivent pas réagir avec la surface de votre électrode ou s'y adsorber trop fortement, à moins que cette interaction ne soit le phénomène spécifique que vous étudiez.
Comprendre les Compromis
Il n'existe pas d'électrolyte unique « meilleur » ; chaque choix implique d'équilibrer des facteurs concurrents. Comprendre ces compromis est la marque d'un chercheur expérimenté.
Conductivité contre Stabilité
Les électrolytes aqueux (par exemple, NaCl dans l'eau) offrent une excellente conductivité ionique mais possèdent une fenêtre de stabilité électrochimique très étroite. Inversement, de nombreux électrolytes à base de solvants organiques offrent une large fenêtre de stabilité mais souffrent souvent d'une conductivité plus faible. Votre choix dépend si votre expérience est limitée par la tension ou par l'efficacité du courant.
Coût contre Pureté
Les sels et solvants de haute pureté, de « qualité batterie » ou de « qualité électrochimique » sont nettement plus chers. Cependant, les impuretés traces (comme l'eau dans un électrolyte non aqueux ou les ions halogénures) peuvent introduire des signaux électrochimiques indésirables et ruiner des mesures sensibles. Pour des démonstrations simples, une qualité inférieure peut suffire, mais pour une analyse quantitative, investir dans la pureté est essentiel.
Le Rôle Spécifique des Ions
Tous les ions ne sont pas créés égaux. Les petits ions mobiles comme le lithium (Li⁺) ou le potassium (K⁺) sont d'excellents porteurs de charge. Cependant, les gros ions organiques comme le tétrabutylammonium (TBA⁺) sont souvent utilisés pour augmenter la solubilité des analytes non polaires dans les solvants polaires et peuvent aider à minimiser les interactions indésirables à la surface de l'électrode.
Faire le Bon Choix pour Votre Expérience
Votre objectif spécifique dicte les propriétés à prioriser.
- Si votre objectif principal est la voltammétrie aqueuse standard : Privilégiez une conductivité élevée et utilisez un sel simple et inerte comme le chlorure de potassium (KCl) ou le sulfate de sodium (Na₂SO₄), en vous assurant que votre plage de potentiel reste dans la fenêtre de stabilité de l'eau.
- Si votre objectif principal est la recherche sur les batteries haute tension : Privilégiez une large fenêtre de stabilité électrochimique et une pureté extrême, en utilisant généralement des sels comme LiPF₆ ou LiClO₄ dans un mélange de solvants carbonates organiques.
- Si votre objectif principal est l'étude de la corrosion : Privilégiez la création d'un électrolyte qui imite fidèlement l'environnement réel (par exemple, l'eau salée), tout en veillant à ce qu'il ne corrode pas vos électrodes de référence ou auxiliaires.
- Si votre objectif principal est la spectroélectrochimie : Privilégiez la transparence optique du sel et du solvant dans votre plage de longueurs d'onde souhaitée, en plus des exigences électrochimiques standard.
En fin de compte, l'électrolyte que vous choisissez prépare la scène et définit les règles de l'ensemble de votre mesure électrochimique.
Tableau Récapitulatif :
| Pilier de Sélection | Considération Clé | Impact sur l'Expérience |
|---|---|---|
| Conductivité Ionique | Mobilité ionique élevée | Minimise la perte de tension (chute IR) pour un contrôle précis du potentiel. |
| Fenêtre de Stabilité Électrochimique (FSE) | Plage de tension de stabilité | Prévient la décomposition de l'électrolyte et le masquage par des courants de fond. |
| Solubilité et Dissociation | Dissociation complète du sel en ions | Assure des porteurs de charge suffisants pour une conductivité efficace. |
| Compatibilité Chimique | Inertie avec les composants de la cellule | Évite la corrosion, la contamination et les réactions secondaires indésirables. |
Prêt à optimiser vos expériences électrochimiques avec l'équipement et les consommables de laboratoire appropriés ? Le bon électrolyte n'est qu'une partie de l'équation. KINTEK se spécialise dans la fourniture de fournitures et d'équipements de laboratoire de haute pureté adaptés à l'électrochimie, à la recherche sur les batteries, aux études de corrosion, et plus encore. Nos produits vous aident à obtenir le contrôle précis et les données fiables que votre travail exige.
Contactez nos experts dès aujourd'hui pour discuter des besoins spécifiques de votre application et découvrir comment KINTEK peut soutenir le succès de votre laboratoire.
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique électrochimique à bain-marie double couche
- Cellule électrochimique à électrolyse spectrale en couche mince
Les gens demandent aussi
- Qu'est-ce qu'une cellule de type H ? Un guide des cellules électrochimiques divisées pour des expériences précises
- Quelle est la structure globale de la cellule électrolytique à bain-marie optique double couche de type H ? Conception de précision pour des expériences contrôlées
- Quelles sont les spécifications d'ouverture standard pour une cellule électrolytique à membrane échangeable de type H ? Des orifices asymétriques pour une électrochimie précise
- Quelle est la structure d'une cellule électrolytique à membrane échangeable de type H ? Un guide pour une séparation électrochimique précise
- Quel est le but de la structure à double paroi dans la cellule électrolytique de type H ? Atteindre un contrôle thermique précis



















