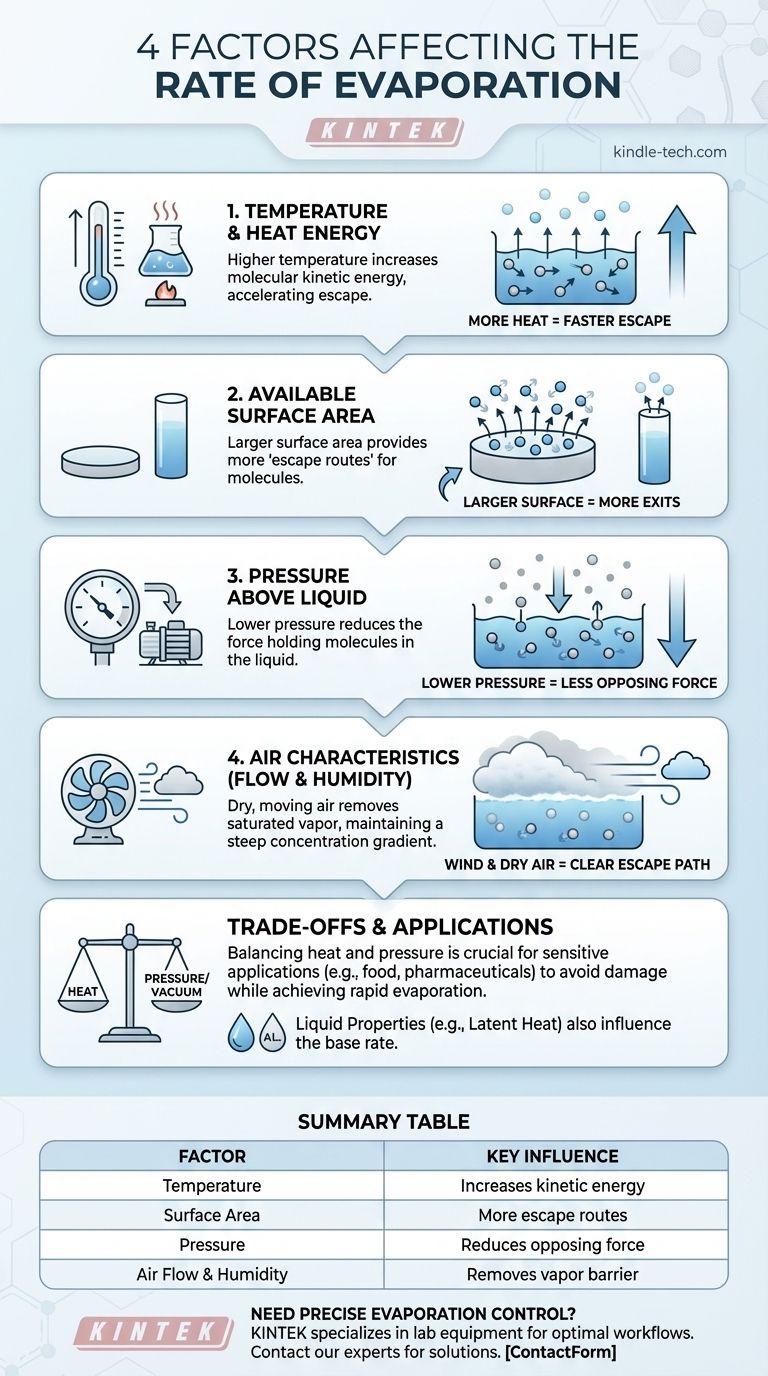
Les quatre principaux facteurs qui affectent le taux d'évaporation sont la température, la surface du liquide, la pression de l'environnement ambiant et les caractéristiques de l'air au-dessus du liquide, telles que son débit et son humidité. Bien que d'autres propriétés comme la capacité thermique spécifique du liquide jouent un rôle, ces quatre variables sont les leviers externes les plus critiques pour contrôler la vitesse à laquelle un liquide se transforme en gaz.
L'évaporation est fondamentalement un processus d'échappement des molécules de la surface d'un liquide. Le taux de cet échappement est déterminé par l'énergie qui pousse les molécules vers l'extérieur par rapport aux forces environnementales qui les repoussent vers l'intérieur. Pour augmenter l'évaporation, vous augmentez soit l'énergie des molécules, soit vous diminuez les forces qui les retiennent.

Facteur 1 : Température et énergie thermique
Le taux d'évaporation est directement lié à la quantité d'énergie thermique disponible. Fournir plus de chaleur accélère considérablement le processus.
Le rôle de l'énergie cinétique
La chaleur est une forme d'énergie. Lorsqu'un liquide est chauffé, ses molécules absorbent cette énergie et commencent à se déplacer plus rapidement, augmentant leur énergie cinétique.
Les molécules ayant suffisamment d'énergie cinétique peuvent surmonter les forces intermoléculaires qui les retiennent dans le liquide et s'échapper de la surface sous forme de gaz. Plus de chaleur signifie que plus de molécules atteignent cette vitesse d'échappement par seconde.
Le taux de transfert de chaleur
La vitesse à laquelle la chaleur peut être transférée dans le liquide est un goulot d'étranglement critique. Une source de chaleur plus efficace ou un liquide avec une meilleure conductivité thermique permettra un taux d'évaporation plus rapide, car l'énergie est fournie plus rapidement aux molécules à la surface.
Facteur 2 : Surface disponible
L'espace physique où l'évaporation peut se produire est un facteur limitant majeur. L'évaporation ne se produit qu'à la surface d'un liquide.
La voie d'évacuation
Considérez la surface du liquide comme la seule sortie d'une pièce bondée. Une plus grande surface est comme avoir plus de portes de sortie – cela permet à plus de molécules de s'échapper simultanément.
Étaler un liquide en une fine pellicule augmente considérablement sa surface, c'est pourquoi une flaque d'eau sur le trottoir s'évapore beaucoup plus rapidement que la même quantité d'eau dans un seau profond.
Facteur 3 : Pression au-dessus du liquide
La pression exercée sur la surface du liquide, typiquement par l'atmosphère, agit comme une barrière physique contre les molécules qui s'échappent.
Le poids de l'air
La pression atmosphérique appuie constamment sur la surface d'un liquide. Cette force rend plus difficile pour les molécules de se libérer et d'entrer dans la phase gazeuse.
Comment une pression plus basse accélère l'évaporation
Lorsque vous réduisez la pression au-dessus d'un liquide — par exemple, en créant un vide ou en vous déplaçant à une altitude plus élevée — vous supprimez une partie de cette force opposée.
Avec moins de pression pour les retenir, les molécules peuvent s'échapper plus facilement et à une température beaucoup plus basse. C'est le principe des évaporateurs sous vide utilisés dans l'industrie alimentaire pour concentrer les liquides sans les endommager avec une chaleur élevée.
Facteur 4 : Caractéristiques de l'air (débit et humidité)
L'état de l'air directement au-dessus de la surface du liquide joue un rôle crucial en favorisant ou en entravant l'évaporation.
Le concept de saturation
L'air ne peut contenir qu'une certaine quantité de vapeur, un état connu sous le nom de saturation. Si l'air directement au-dessus du liquide est déjà saturé de vapeur (c'est-à-dire à 100 % d'humidité), l'évaporation s'arrêtera effectivement car il n'y a plus de place pour que d'autres molécules s'échappent.
Comment le vent et le flux d'air aident
Le vent ou toute forme de flux d'air est extrêmement efficace pour augmenter l'évaporation. Il agit en chassant la couche d'air humide et saturé à la surface et en la remplaçant par de l'air plus sec.
Cela maintient un gradient de concentration prononcé entre le liquide et l'air, garantissant que la "voie d'évacuation" pour les molécules reste dégagée et encourageant un taux d'évaporation élevé et continu.
Comprendre les compromis
Ces facteurs n'opèrent pas de manière isolée ; ils interagissent les uns avec les autres et avec les propriétés intrinsèques du liquide lui-même.
Chaleur vs Pression
Dans de nombreuses applications industrielles, l'application de quantités massives de chaleur est soit inefficace, soit endommagerait le produit (comme les aliments ou les produits pharmaceutiques).
En abaissant significativement la pression, les opérateurs peuvent obtenir une évaporation rapide à des températures beaucoup plus basses, préservant ainsi la qualité du produit final. C'est un compromis direct entre les deux facteurs.
Les propriétés propres du liquide
Certains liquides s'évaporent intrinsèquement plus rapidement que d'autres. Cela est dû à des facteurs tels que la chaleur latente de vaporisation — la quantité d'énergie nécessaire pour convertir une unité du liquide en gaz.
L'eau a une chaleur latente élevée, nécessitant beaucoup d'énergie pour s'évaporer. En revanche, les liquides comme l'alcool ont des forces intermoléculaires plus faibles et une chaleur latente plus faible, ce qui leur permet de s'évaporer beaucoup plus rapidement dans les mêmes conditions.
Faire le bon choix pour votre objectif
Votre approche de la gestion de l'évaporation dépend entièrement du résultat souhaité.
- Si votre objectif principal est d'accélérer l'évaporation (par exemple, sécher des vêtements) : Augmentez la température (lumière du soleil), maximisez la surface (étalez-les) et assurez une bonne circulation de l'air (une journée venteuse ou un ventilateur).
- Si votre objectif principal est de ralentir l'évaporation (par exemple, préserver une réserve d'eau) : Réduisez la surface (utilisez un réservoir profond et étroit), couvrez-le pour arrêter la circulation de l'air, et gardez-le au frais et à l'ombre.
- Si votre objectif principal est un traitement industriel efficace (par exemple, concentrer du jus) : Abaisser la pression est la méthode la plus efficace pour une évaporation rapide sans utiliser de températures excessivement élevées.
En comprenant ces principes physiques fondamentaux, vous pouvez contrôler efficacement le taux d'évaporation pour toute application.
Tableau récapitulatif :
| Facteur | Influence clé sur le taux d'évaporation |
|---|---|
| Température | Une température plus élevée augmente l'énergie cinétique moléculaire, accélérant l'échappement. |
| Surface | Une plus grande surface offre plus de "voies d'échappement" pour les molécules. |
| Pression | Une pression plus basse réduit la force retenant les molécules dans le liquide. |
| Flux d'air & Humidité | L'air sec et en mouvement élimine la vapeur saturée, maintenant un gradient de concentration prononcé. |
Besoin d'un contrôle précis de l'évaporation dans votre laboratoire ? Que vous concentriez des échantillons, séchiez des matériaux ou développiez de nouveaux processus, comprendre ces facteurs n'est que la première étape. KINTEK est spécialisé dans l'équipement de laboratoire qui met ces connaissances en pratique — des chauffe-ballons et plaques chauffantes précis aux évaporateurs sous vide efficaces. Laissez nos experts vous aider à sélectionner le bon équipement pour optimiser votre flux de travail. Contactez notre équipe dès aujourd'hui pour une consultation personnalisée !
Guide Visuel
Produits associés
- Bateau d'évaporation pour matière organique
- Unité de distillation d'eau murale
- Creuset d'évaporation pour matière organique
- Pompe à vide à circulation d'eau verticale de laboratoire pour usage en laboratoire
- Pompe à vide à circulation d'eau de laboratoire pour usage en laboratoire
Les gens demandent aussi
- Qu'est-ce que le dépôt sous vide de métaux ? Un guide sur les revêtements métalliques durables et de haute pureté
- Quel est le processus de revêtement sous vide ? Obtenez une ingénierie de surface supérieure pour vos produits
- Quelle est la différence entre l'évaporation thermique et l'évaporation par faisceau d'électrons ? Découvrez la bonne méthode de dépôt de couches minces
- Comment fonctionne le dépôt par faisceau d'électrons ? Obtenez des revêtements optiques et polymères haute performance
- Quel est l'avantage de l'e-beam ? Une stérilisation rapide et respectueuse des matériaux pour les laboratoires modernes
- Quels sont les facteurs qui affectent l'évaporation ? Contrôler le taux de vaporisation de tout liquide
- Quel est le processus de dépôt sous vide ? Obtenez des revêtements de précision au niveau atomique
- À quel point l'or s'évapore-t-il ? La science derrière la résistance extrême de l'or à la chaleur




