Découvertes historiques en électrochimie
L'expérience de la grenouille de Galvani
En 1791, le scientifique italien Luigi Galvani a réalisé une expérience révolutionnaire qui allait lier à jamais la biologie et l'électrochimie. Lors de la dissection d'une patte de grenouille, Galvani a remarqué que la patte s'agitait lorsqu'elle entrait en contact avec deux métaux différents. Cette observation apparemment simple a conduit à une prise de conscience profonde : les tissus biologiques pouvaient générer des signaux électriques et y répondre.
Cette découverte n'était pas seulement une curiosité académique, elle avait aussi des implications pratiques. Le phénomène observé par Galvani a été baptisé plus tard "action galvanique" et a jeté les bases du développement d'appareils tels que le galvanomètre, un instrument utilisé pour mesurer de petits courants électriques. En outre, le processus de galvanisation - le revêtement des métaux pour prévenir la corrosion - a été nommé en son honneur, ce qui souligne l'impact durable de ses travaux.
L'expérience de Galvani a marqué un tournant dans l'histoire de la science, en comblant le fossé entre les sciences de la vie et les sciences physiques. Elle a démontré que les systèmes biologiques pouvaient être compris à travers les principes de l'électrochimie, ouvrant la voie à de futures avancées dans les deux domaines.
L'invention de la pile voltaïque par Volta
En 1799, Alessandro Volta, physicien italien, a fait une découverte révolutionnaire qui a jeté les bases des systèmes électrochimiques modernes. Il a inventé la première source d'énergie chimique, connue sous le nom de pile voltaïque, qui consistait essentiellement en une pile de disques de cuivre et de zinc séparés par un tissu ou un carton humidifié et trempé dans de la saumure. Ce dispositif simple mais ingénieux pouvait générer un courant électrique régulier, marquant l'aube de la production pratique d'électricité.
L'importance de l'invention de Volta a été rapidement reconnue et elle a stimulé la recherche sur les applications potentielles de cette nouvelle source d'énergie. Un an plus tard, en 1800, William Nicholson et Anthony Carlisle ont utilisé une pile voltaïque pour réaliser la première électrolyse réussie de l'eau. Au cours de cette expérience, ils ont observé la précipitation de gaz, notamment de l'hydrogène et de l'oxygène, ce qui confirmait la décomposition des molécules d'eau en leurs éléments constitutifs sous l'influence d'un courant électrique.
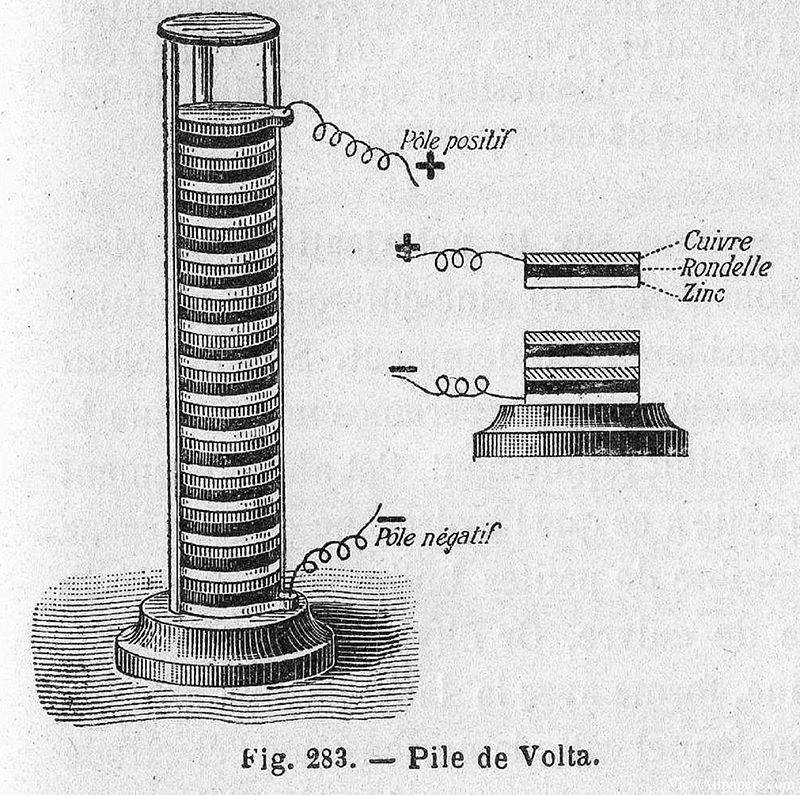
Cette découverte a non seulement validé le concept de l'électrolyse, mais a également démontré l'utilité pratique de la pile de Volta dans l'expérimentation scientifique. La possibilité de décomposer les composés en leurs éléments constitutifs à l'aide de l'électricité a ouvert de nouvelles voies de recherche en chimie et en physique, ouvrant la voie à de futures avancées dans la théorie et les applications de l'électrochimie.
Succès de l'électrolyse
En 1803, Humphry Davy a obtenu un succès révolutionnaire dans le domaine de l'électrochimie en réussissant à isoler les métaux potassium et sodium par le processus de l'électrolyse. Cette découverte monumentale a non seulement démontré la puissance des méthodes électrochimiques, mais a également ouvert la voie à la production de monomères métalliques actifs, qui sont essentiels dans diverses applications industrielles.
Les expériences de Davy impliquaient l'utilisation d'une pile voltaïque, la première source d'énergie chimique inventée par Alessandro Volta. En faisant passer un courant électrique à travers des sels fondus, Davy a pu décomposer ces composés et obtenir des métaux purs. Cette technique a marqué une avancée significative dans l'extraction des métaux réactifs, qui étaient auparavant difficiles à isoler à l'aide de méthodes chimiques traditionnelles.
Les implications des travaux de Davy ont dépassé le cadre du laboratoire. Son succès dans le domaine de l'électrolyse a jeté les bases des futures recherches sur les processus électrochimiques, qui ont permis de mettre au point des méthodes plus efficaces d'extraction et de purification des métaux. Cette découverte a également mis en évidence le potentiel des techniques électrochimiques dans divers secteurs industriels, de la métallurgie à la fabrication de produits chimiques.
En outre, les découvertes de Davy ont contribué à une meilleure compréhension des principes électrochimiques, ouvrant la voie à des avancées théoriques ultérieures telles que la loi de Faraday sur l'électrolyse et l'équation de Nernst. Ces cadres théoriques, à leur tour, ont permis des études quantitatives plus précises des phénomènes électrochimiques, faisant encore progresser le domaine.
En résumé, l'électrolyse réussie du potassium et du sodium par Davy en 1803 a marqué un tournant dans l'histoire de l'électrochimie, en démontrant les applications pratiques des méthodes électrochimiques et en jetant les bases des innovations futures dans ce domaine.
Fondements théoriques de l'électrochimie
La loi de Faraday sur l'électrolyse
En 1834, Michael Faraday, physicien et chimiste pionnier, a formulé la loi de l'électrolyse, pierre angulaire du domaine de l'électrochimie. Cette loi a fourni un cadre quantitatif pour la compréhension et l'analyse des phénomènes électrochimiques, faisant ainsi progresser de manière significative les fondements théoriques de la discipline. Les travaux de Faraday ont permis de combler le fossé entre les observations empiriques et les modèles théoriques, jetant ainsi les bases des futures découvertes et applications en électrochimie.
La loi de l'électrolyse de Faraday se compose de deux principes fondamentaux :
- Première loi: La masse d'une substance déposée ou libérée à une électrode pendant l'électrolyse est directement proportionnelle à la quantité d'électricité qui traverse l'électrolyte.
- Deuxième loi: La masse d'une substance déposée ou libérée à une électrode lors de l'électrolyse est directement proportionnelle au poids équivalent chimique de la substance.
Ces lois ont permis aux scientifiques de mesurer avec précision la quantité de matière transformée au cours d'une réaction électrochimique, facilitant ainsi le développement de procédures et de techniques normalisées en électrochimie. En quantifiant la relation entre le courant électrique, le temps et les changements chimiques qui en résultent, les lois de Faraday ont fourni une méthode solide pour étudier et prédire les processus électrochimiques.
L'impact des travaux de Faraday s'est étendu au-delà de la simple quantification. Ses lois ont favorisé une meilleure compréhension des mécanismes sous-jacents à l'électrolyse, ce qui a permis de faire progresser diverses applications pratiques. Ces applications vont des processus industriels tels que l'affinage des métaux et la galvanoplastie au développement de batteries et de piles à combustible, qui font partie intégrante des systèmes énergétiques modernes.
En outre, les contributions de Faraday ont ouvert la voie aux développements théoriques ultérieurs en électrochimie. Ses lois ont été à la base des travaux de scientifiques ultérieurs tels que Walther Nernst, qui a dérivé l'équation de Nernst, et Julius Tafel, qui a formulé l'équation de Tafel. Ces avancées ont permis d'affiner la compréhension des potentiels d'électrode, de la cinétique des réactions et du comportement des ions en solution, autant d'aspects essentiels de la recherche électrochimique moderne.
En résumé, la loi de l'électrolyse de Faraday a non seulement révolutionné l'étude quantitative des phénomènes électrochimiques, mais elle a également jeté des bases théoriques solides pour le domaine naissant de l'électrochimie. Ses travaux continuent d'influencer et d'inspirer la recherche et les applications contemporaines, soulignant l'importance durable de ses contributions à la science.
L'équation de Nernst
En 1889, le chimiste allemand Walther Nernst a apporté une contribution révolutionnaire au domaine de l'électrochimie en établissant une relation mathématique qui reliait le potentiel de l'électrode à la concentration des substances impliquées dans la réaction électrochimique. Cette relation, connue aujourd'hui sous le nom d'équation de Nernst, est devenue la pierre angulaire de l'étude des systèmes électrochimiques.
L'équation de Nernst fournit un moyen quantitatif de prédire le potentiel d'une cellule électrochimique dans des conditions non standard, ce qui est crucial pour comprendre et contrôler les processus électrochimiques. Elle s'exprime comme suit :
[ E = E^\circ - \frac{RT}{nF} \ln Q ]
où :
- ( E ) est le potentiel de l'électrode.
- ( E^\circ ) est le potentiel standard de l'électrode.
- ( R ) est la constante universelle des gaz.
- ( T ) est la température en Kelvin.
- ( n ) est le nombre de moles d'électrons transférés dans la réaction.
- ( F ) est la constante de Faraday.
- ( Q ) est le quotient de réaction.
L'équation démontre comment les changements de concentration peuvent influencer le potentiel d'une électrode, ce qui est vital pour des applications allant de la conception de batteries aux processus d'électrolyse industrielle. En permettant aux scientifiques de prédire et de manipuler les potentiels des électrodes, l'équation de Nernst a considérablement fait progresser notre capacité à concevoir et à optimiser les systèmes électrochimiques.
Cette découverte n'était pas seulement un triomphe théorique, mais aussi pratique, car elle a fourni un outil aux scientifiques et aux ingénieurs pour mieux comprendre et contrôler le comportement des cellules électrochimiques dans diverses conditions. L'équation de Nernst reste un élément indispensable de la théorie et de la pratique de l'électrochimie, ce qui souligne l'impact profond des travaux de Nernst sur ce domaine.
L'équation de Tafel
En 1905, Julius Tafel a présenté une formule empirique révolutionnaire qui établissait une relation directe entre la densité de courant et le surpotentiel de l'hydrogène. Cette équation, connue sous le nom d'équation de Tafel, a joué un rôle essentiel dans l'avancement de notre compréhension de la cinétique électrochimique. Les travaux de Tafel ont permis d'élucider les mécanismes qui sous-tendent la vitesse des réactions électrochimiques, en particulier celles qui impliquent un dégagement d'hydrogène.
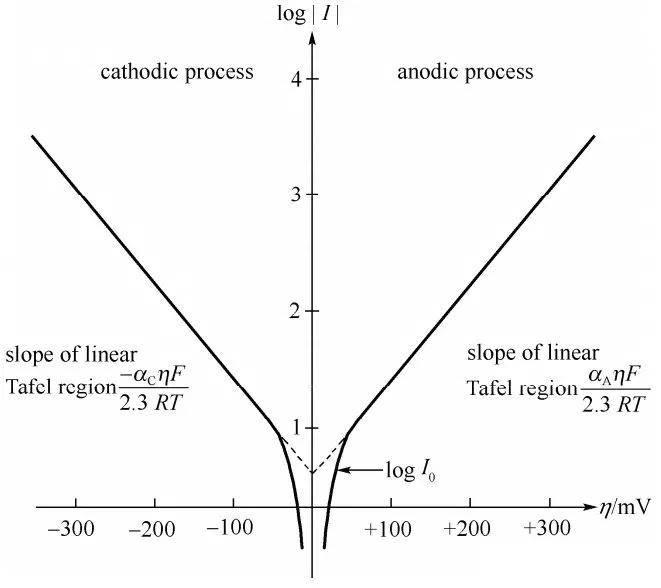
L'équation de Tafel est généralement exprimée comme suit :
$$ \eta = a + b \log(i) $$
où :
- (\eta) est le surpotentiel,
- (i) est la densité de courant,
- (a) et (b) sont des constantes spécifiques au matériau de l'électrode et aux conditions de réaction.
L'importance de l'équation de Tafel réside dans sa capacité à décrire quantitativement la vitesse des processus électrochimiques, ce qui est crucial pour optimiser les matériaux d'électrode et les conditions de réaction. Cette loi empirique a été largement validée et appliquée à divers systèmes électrochimiques, de la recherche fondamentale aux applications industrielles.
| Paramètre | Description de la loi |
|---|---|
| (\eta) | Surpotentiel, tension supplémentaire requise au-delà du potentiel d'équilibre |
| (i) | Densité de courant, courant par unité de surface de l'électrode |
| (a) | Constante liée à la densité de courant d'échange et au facteur de symétrie |
| (b) | Pente de Tafel, liée au coefficient de transfert de charge |
Le travail de pionnier de Tafel a jeté les bases des recherches ultérieures en cinétique électrochimique, influençant le développement de théories et de techniques plus sophistiquées. Son équation reste une pierre angulaire dans le domaine, soulignant l'interaction complexe entre les processus électriques et chimiques en électrochimie.
Cinétique et techniques électrochimiques
À partir de 1940, le domaine de l'électrochimie interfaciale a connu des avancées significatives, notamment dans la compréhension de la structure de la double couche et de la cinétique de la précipitation de l'hydrogène. Ces développements ont jeté les bases de théories et de techniques plus sophistiquées dans le domaine de la cinétique électrochimique. L'une des contributions les plus remarquables de cette période a été l'établissement de la théorie microscopique de Marcus sur le transfert d'électrons. Cette théorie a fourni un cadre détaillé pour comprendre comment les électrons se déplacent à travers les interfaces, ce qui est crucial pour de nombreux processus électrochimiques.
Les progrès de la cinétique électrochimique ne se sont pas limités aux constructions théoriques. Les techniques expérimentales ont également évolué, permettant aux chercheurs de sonder le comportement des électrons et des ions aux interfaces avec une plus grande précision. Par exemple, le développement de nouvelles méthodes spectroscopiques a permis d'observer en temps réel les réactions chimiques se produisant à la surface des électrodes. Ces techniques ont permis de valider et d'affiner les modèles théoriques, tels que la théorie de Marcus, en fournissant des données empiriques qui peuvent être directement comparées aux prédictions théoriques.
En outre, l'interaction entre les progrès théoriques et expérimentaux a permis de développer des systèmes électrochimiques plus efficaces. Par exemple, la compréhension de la cinétique de précipitation de l'hydrogène a été appliquée à la conception de meilleures piles à combustible et batteries, qui sont essentielles pour les technologies modernes de stockage et de conversion de l'énergie. Ces systèmes bénéficient d'une cinétique améliorée, ce qui se traduit par une plus grande efficacité et des durées de vie plus longues.
En résumé, la période à partir de 1940 a marqué une ère de transformation de la cinétique et des techniques électrochimiques. La synergie entre les connaissances théoriques et les capacités expérimentales a non seulement permis d'approfondir notre compréhension des processus fondamentaux, mais a également ouvert la voie à des applications pratiques dans les domaines de l'énergie et de la science des matériaux.
Techniques électrochimiques in situ
Depuis leur apparition dans les années 1970, les techniques électrochimiques in situ ont révolutionné l'exploration des mécanismes électrochimiques. Ces techniques permettent aux chercheurs d'observer et d'analyser les processus électrochimiques directement dans leur environnement opérationnel, ce qui donne un aperçu inégalé de la dynamique des réactions à l'interface électrode-électrolyte.
L'une des avancées les plus significatives dans ce domaine est l'intégration de la spectroscopie d'absorption des rayons X (XAS) électrochimique in situ. Cette méthode permet de surveiller en temps réel les changements dans la structure électronique et les états d'oxydation des matériaux au cours des réactions électrochimiques. En combinant la XAS avec des techniques électrochimiques, les scientifiques peuvent établir une corrélation entre les transformations structurelles et les performances électrochimiques, ce qui permet d'approfondir notre compréhension des processus catalytiques et des matériaux d'électrodes.
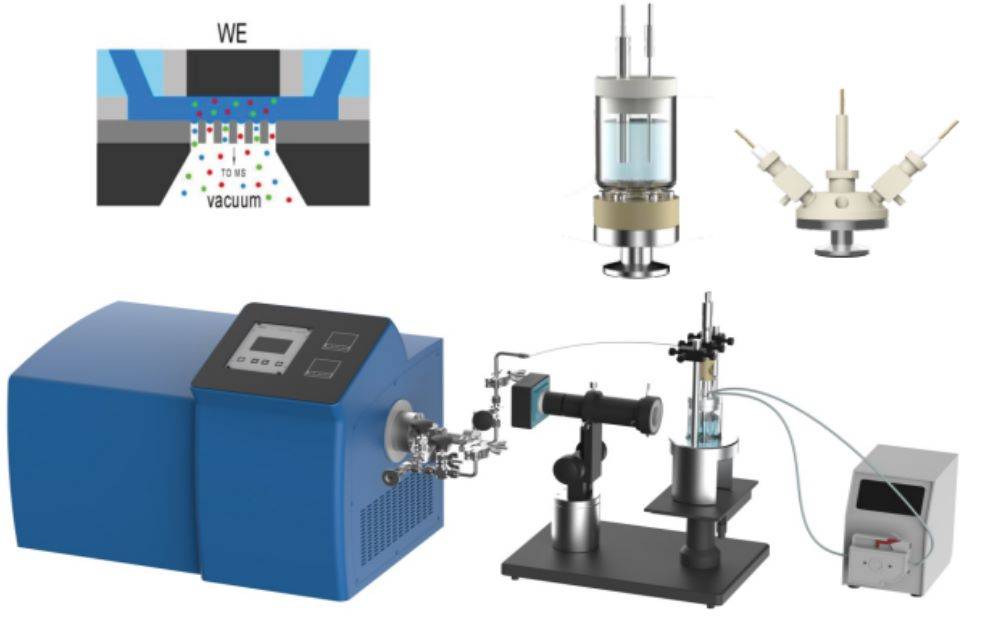
Outre la XAS, d'autres techniques in situ telles que la microscopie électrochimique à balayage (SECM) et la spectroscopie Raman in situ ont également gagné en importance. La SECM permet une résolution spatiale des processus électrochimiques à l'échelle du micromètre, tandis que la spectroscopie Raman in situ fournit des informations vibrationnelles détaillées sur les espèces impliquées dans les réactions.
La polyvalence et la précision des techniques électrochimiques in situ ont non seulement amélioré la recherche fondamentale, mais aussi accéléré le développement d'applications pratiques. Par exemple, ces techniques permettent d'optimiser les performances des batteries, des piles à combustible et des électrocatalyseurs. En fournissant des données en temps réel sur les intermédiaires réactionnels et les modifications de surface, les méthodes in situ aident à concevoir des dispositifs électrochimiques plus efficaces et plus durables.
En outre, l'évolution constante de ces techniques élargit leur champ d'application. Les progrès de l'instrumentation et des méthodes d'analyse des données permettent une meilleure résolution, une acquisition plus rapide des données et une interprétation plus précise des résultats. Ces progrès ouvrent la voie à la prochaine génération de recherche électrochimique, où les techniques in situ joueront un rôle essentiel dans l'élucidation des complexités des systèmes électrochimiques.
Orientations modernes en électrochimie
Mécanismes électrochimiques microscopiques
L'exploration des processus électrochimiques à l'échelle atomique et moléculaire est un point central de la recherche contemporaine. Ce domaine utilise principalement des méthodes in situ et non in situ pour disséquer les mécanismes complexes qui régissent ces processus. Ces techniques permettent aux chercheurs d'observer et d'analyser les réactions électrochimiques au fur et à mesure qu'elles se produisent, ce qui donne un aperçu sans précédent de la dynamique en jeu.
L'une des principales avancées dans ce domaine est l'utilisation de la technique d'absorption électrochimique des rayons X in situ. spectroscopie d'absorption des rayons X (XAS) électrochimique in situ . Cette méthode permet de surveiller en temps réel les changements dans la structure électronique et les états d'oxydation des matériaux au cours des réactions électrochimiques. Par exemple, la XAS peut révéler comment la surface d'un catalyseur change pendant la catalyse d'une réaction spécifique, offrant des indices pour optimiser le catalyseur en vue d'une meilleure performance.
En outre, la microscopie à effet tunnel (STM) et microscopie à force atomique (AFM) ont permis de visualiser la morphologie de la surface et les propriétés électroniques des électrodes au niveau atomique. Ces techniques ont été cruciales pour comprendre comment les défauts de surface, les adsorbats et d'autres caractéristiques microscopiques influencent le comportement électrochimique des matériaux.
Pour construire un mécanisme de réaction complet et rationnel, les chercheurs combinent souvent ces observations microscopiques avec des modèles théoriques. Par exemple, la théorie de la fonctionnelle de la densité (DFT) peuvent prédire les paysages énergétiques des voies de réaction potentielles, tandis que la dynamique moléculaire (MD) peuvent modéliser le comportement des ions et des molécules dans l'électrolyte en fonction du temps.
L'intégration des approches expérimentales et théoriques a permis des avancées significatives dans ce domaine. Par exemple, la conception rationnelle d'électrocatalyseurs pour la séparation de l'eau et la réduction du CO₂ a été guidée par les connaissances acquises grâce à ces efforts combinés. De telles avancées améliorent non seulement notre compréhension fondamentale des processus électrochimiques, mais ouvrent également la voie au développement de technologies énergétiques plus efficaces et durables.
En résumé, l'utilisation de techniques avancées in situ et non in situ, associée à la modélisation théorique, a révolutionné l'étude des mécanismes électrochimiques au niveau microscopique. Cette approche interdisciplinaire continue de stimuler l'innovation dans la recherche universitaire et les applications industrielles.
Progrès dans les essais électrochimiques
Les méthodes électrochimiques traditionnelles subissent des transformations significatives pour répondre aux exigences contemporaines. Ces progrès sont motivés par la nécessité d'améliorer la sensibilité de la surveillance, de s'adapter à des conditions environnementales extrêmes et d'intégrer des traitements mathématiques sophistiqués. L'évolution des techniques d'essai électrochimique n'est pas simplement une amélioration progressive, mais un changement de paradigme qui comble le fossé entre la compréhension théorique et l'application pratique.
L'un des principaux domaines de développement est l'intégration de modèles mathématiques avancés. Ces modèles permettent des prédictions et des interprétations plus précises des phénomènes électrochimiques, en particulier dans les systèmes complexes où les méthodes traditionnelles ne suffisent pas. Par exemple, l'intégration d'algorithmes d'apprentissage automatique a permis l'analyse et l'optimisation en temps réel des processus électrochimiques, réduisant considérablement le temps et les ressources nécessaires à l'expérimentation.

En outre, l'adaptabilité de ces méthodes à des conditions extrêmes a ouvert de nouvelles voies de recherche et d'application. Qu'il s'agisse des températures élevées des processus industriels ou des basses températures de l'exploration spatiale, les techniques électrochimiques modernes sont conçues pour fonctionner de manière fiable et efficace. Cette adaptabilité est cruciale pour les industries allant de la production d'énergie à la science des matériaux, où les conditions peuvent varier considérablement.
Outre les avancées mathématiques, les composants matériels des tests électrochimiques ont également connu des améliorations remarquables. Les capteurs de haute précision et les systèmes automatisés sont désormais monnaie courante, ce qui permet une surveillance et une collecte de données en continu. Ces systèmes sont non seulement plus précis, mais aussi plus conviviaux, ce qui rend les essais électrochimiques avancés accessibles à un plus grand nombre de chercheurs et d'industries.
La synergie entre ces progrès en matière de modélisation mathématique, d'adaptabilité à l'environnement et d'amélioration du matériel a conduit à une nouvelle ère dans les essais électrochimiques. Cette ère se caractérise par une précision, une efficacité et une applicabilité accrues, ouvrant la voie à des percées tant dans la recherche fondamentale que dans les applications pratiques.
Applications interdisciplinaires
La polyvalence de l'électrochimie est évidente dans son large éventail d'applications dans divers domaines scientifiques et industriels. L'un des domaines d'application les plus importants est l'électrosynthèse qui utilise des processus électrochimiques pour synthétiser des composés organiques et inorganiques complexes. Cette méthode est particulièrement utile pour la production de produits pharmaceutiques, agrochimiques et de spécialités chimiques, car elle permet de contrôler précisément les conditions de réaction et de minimiser les déchets.
Les procédés d'électrolyse sont une autre pierre angulaire de l'électrochimie moderne, jouant un rôle crucial dans la production de produits chimiques industriels essentiels tels que le chlore et l'hydroxyde de sodium dans l'industrie du chlore et de la soude. En outre, l'électrolyse est vitale pour l'extraction de métaux comme l'aluminium et pour la production d'hydrogène par électrolyse de l'eau, ce qui est essentiel pour les solutions énergétiques durables.
La protection contre la corrosion est une application critique où les principes électrochimiques sont utilisés pour protéger les métaux de la dégradation. Des techniques telles que la galvanoplastie, la protection par anode sacrificielle et la protection anodique sont largement utilisées pour prolonger la durée de vie des structures métalliques dans divers environnements, qu'il s'agisse de milieux marins ou d'installations industrielles.
L'électrocatalyse représente un domaine de pointe où l'électrochimie croise la catalyse pour améliorer l'efficacité des réactions chimiques. Ceci est particulièrement important pour le développement des piles à combustible, qui convertissent l'énergie chimique directement en énergie électrique avec une grande efficacité et un impact minimal sur l'environnement.
Dans le domaine des nouvelles sources d'énergie L'électrochimie est à la pointe de la recherche sur les technologies de batteries avancées, notamment les batteries lithium-ion et les batteries à l'état solide. Ces technologies sont essentielles pour la transition vers les systèmes d'énergie renouvelable, car elles offrent des densités d'énergie plus élevées et des durées de vie plus longues que les batteries traditionnelles.
La photoélectrochimie fusionne la photochimie et l'électrochimie, en utilisant l'énergie lumineuse pour déclencher des réactions électrochimiques. Ce domaine est crucial pour le développement des cellules solaires et de la séparation photoélectrochimique de l'eau, qui permet de convertir directement la lumière du soleil en hydrogène, un carburant propre et abondant.
Enfin, la bioélectrochimie est une discipline émergente qui applique les principes électrochimiques aux systèmes biologiques. Cela inclut le développement de biocapteurs pour le diagnostic médical et la bioélectrocatalyse pour la biorestauration et la production de bioénergie. Ces applications soulignent l'impact profond de l'électrochimie sur la santé humaine et la durabilité environnementale.
Applications pratiques de l'électrochimie
Électrolyse et électrosynthèse
L'électrolyse et l'électrosynthèse jouent un rôle essentiel dans la transformation des matières premières en produits de valeur et dans la mise en œuvre de plusieurs processus industriels. L'industrie du industrie du chlore et de la soude est une pierre angulaire, utilisant l'électrolyse pour produire du chlore et de l'hydroxyde de sodium, essentiels pour divers processus chimiques et secteurs de fabrication. Ce processus garantit non seulement un approvisionnement régulier de ces produits chimiques, mais souligne également l'efficacité et l'évolutivité des méthodes électrochimiques.
Dans le domaine de l électrolyse de l'aluminium le procédé Hall-Héroult reste indispensable. Cette méthode, qui implique la réduction électrolytique de l'alumine dissoute dans la cryolithe fondue, est cruciale pour l'industrie mondiale de production d'aluminium. Le perfectionnement et l'optimisation continus de ce procédé ont permis de réduire considérablement la consommation d'énergie et l'impact sur l'environnement, ce qui en fait un modèle de pratique industrielle durable.

L'électrolyse de l'eau a fait l'objet d'une attention particulière, notamment dans le contexte du stockage des énergies renouvelables et de la production d'hydrogène. En séparant l'eau en hydrogène et en oxygène à l'aide d'un courant électrique, ce procédé offre une solution propre et évolutive pour produire de l'hydrogène, qui peut être stocké et utilisé pour alimenter diverses applications, des transports aux processus industriels.
L'électrosynthèse élargit le champ des applications électrochimiques en permettant la synthèse de molécules organiques complexes et de produits pharmaceutiques. Cette technique permet un contrôle précis des conditions de réaction, ce qui se traduit par des rendements plus élevés et une plus grande pureté des produits. La polyvalence de l'électrosynthèse est illustrée par son utilisation dans la production de produits chimiques fins, de produits agrochimiques et de matériaux de spécialité, ce qui renforce son importance dans la fabrication de produits chimiques modernes.
Ces applications soulignent collectivement le potentiel de transformation de l'électrolyse et de l'électrosynthèse, en stimulant l'innovation dans de nombreuses industries et en contribuant aux objectifs de développement durable.
Corrosion et protection des métaux
La corrosion des métaux est un problème important dans diverses industries, entraînant des pertes économiques substantielles et des risques pour la sécurité. Pour atténuer ces effets, plusieurs méthodes avancées ont été développées et mises en œuvre. Parmi celles-ci, citons galvanoplastie est une technique polyvalente qui permet non seulement de rehausser l'attrait esthétique des métaux, mais aussi d'améliorer considérablement leur résistance à la corrosion. En déposant une fine couche d'un métal plus résistant à la corrosion sur la surface du métal de base, la galvanoplastie agit comme une barrière protectrice contre les éléments environnementaux.
Une autre méthode efficace est la la protection par anode sacrificielle qui consiste à fixer un métal plus réactif à la structure à protéger. Ce métal sacrificiel, souvent constitué de magnésium ou de zinc, se corrode préférentiellement, protégeant ainsi le métal sous-jacent de la corrosion. Cette technique est largement utilisée dans les environnements marins où les taux de corrosion sont particulièrement élevés.
La protection anodique est une autre approche sophistiquée qui consiste à polariser un métal à un potentiel tel qu'il devient passif, réduisant ainsi de manière significative son taux de corrosion. Cette méthode est particulièrement efficace pour les métaux qui peuvent former une couche d'oxyde stable, comme l'acier inoxydable. En contrôlant le potentiel, la protection anodique peut prolonger la durée de vie des infrastructures critiques dans des industries telles que le traitement chimique et le raffinage du pétrole.
Ces méthodes, ainsi que d'autres comme la la protection cathodique et les technologies de revêtement forment ensemble un arsenal solide contre la corrosion des métaux, garantissant la longévité et la fiabilité des structures métalliques dans diverses applications.
Bioélectrochimie
La bioélectrochimie représente une intersection fascinante entre la biologie et l'électrochimie, avec des applications qui vont du diagnostic médical à la surveillance de l'environnement. L'une des applications les plus importantes est le développement de biocapteurs qui utilisent des molécules biologiques pour détecter et quantifier des substances spécifiques. Ces capteurs sont essentiels au diagnostic médical, car ils permettent la détection rapide et précise de biomarqueurs, d'hormones et d'agents pathogènes. Par exemple, les biocapteurs de glucose sont largement utilisés dans la gestion du diabète, car ils permettent de surveiller en temps réel les niveaux de glucose dans le sang.
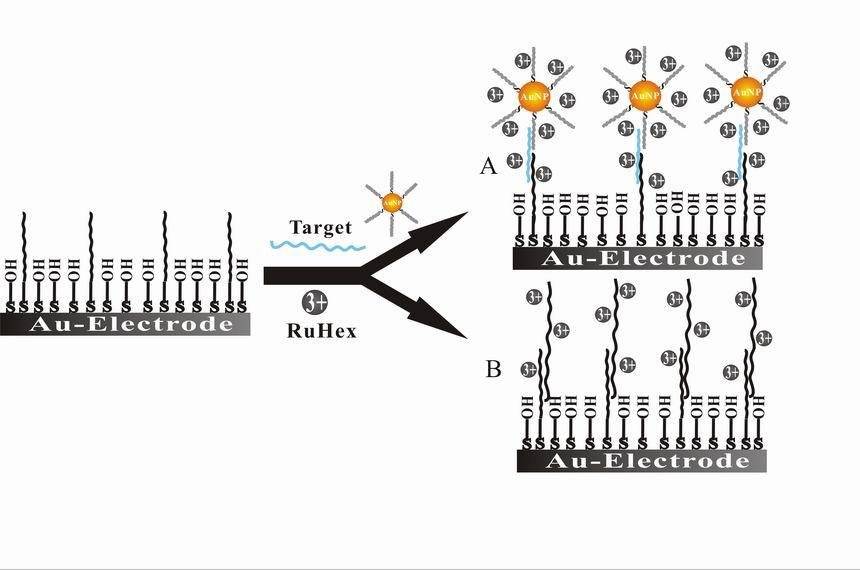
Outre les biocapteurs, bioélectrocatalyse est un autre domaine essentiel de la bioélectrochimie. Ce domaine se concentre sur l'utilisation d'enzymes ou de micro-organismes comme catalyseurs dans les réactions électrochimiques, améliorant ainsi l'efficacité et la spécificité de ces processus. La bioélectrocatalyse a des implications significatives dans les domaines des énergies renouvelables, du traitement des déchets et des processus industriels. Par exemple, les piles à combustible microbiennes utilisent la bioélectrocatalyse pour convertir les déchets organiques directement en électricité, offrant ainsi une solution durable pour la production d'énergie et la gestion des déchets.
| Application | Description de l'application | Exemple d'application |
|---|---|---|
| Biocapteurs | Utilisation de molécules biologiques pour la détection et la quantification | Biocapteurs de glucose pour la gestion du diabète |
| Bioélectrocatalyse | Utilisation d'enzymes ou de micro-organismes comme catalyseurs dans les réactions électrochimiques | Piles à combustible microbiennes pour la production d'énergie à partir de déchets organiques |
La synergie entre les principes biologiques et électrochimiques de la bioélectrochimie continue à stimuler l'innovation, promettant de nouveaux outils et méthodes pour la recherche scientifique et les applications pratiques.
Alimentations chimiques
Les sources d'énergie chimiques englobent un large éventail de technologies, chacune ayant des caractéristiques et des applications uniques. Les principales catégories comprennent les piles primaires, les piles secondaires, les batteries lithium-ion et les piles à combustible. Les piles primaires, telles que les piles alcalines et les piles zinc-carbone, sont conçues pour un usage unique et sont couramment utilisées dans les appareils de tous les jours tels que les télécommandes et les lampes de poche. Les piles secondaires, ou piles rechargeables, comprennent les piles plomb-acide et les piles nickel-hydrure métallique, qui peuvent être rechargées plusieurs fois, ce qui les rend idéales pour les applications nécessitant une puissance soutenue sur de longues périodes.
Les batteries lithium-ion ont révolutionné l'électronique portable et les véhicules électriques en raison de leur haute densité énergétique, de leur longue durée de vie et de leur faible taux d'autodécharge. Ces batteries sont composées de composés de lithium comme électrodes et d'un électrolyte non aqueux, offrant un équilibre entre le coût, la performance et l'impact sur l'environnement.
Les piles à combustible, quant à elles, représentent une avancée significative dans la technologie de l'énergie durable. Contrairement aux batteries, qui stockent l'énergie chimiquement, les piles à combustible produisent de l'électricité par la réaction électrochimique d'un combustible, généralement de l'hydrogène, avec un oxydant, généralement de l'oxygène. Ce processus se traduit par un rendement élevé, une faible pollution et la possibilité d'ajuster la production d'électricité en fonction de la demande. Les piles à combustible sont particulièrement prometteuses pour des applications telles que les véhicules électriques, les systèmes d'alimentation de secours et même l'exploration spatiale, où une énergie fiable et propre est primordiale.
| Type de batterie | Principaux cas d'utilisation | Principaux avantages |
|---|---|---|
| Batteries primaires | Appareils à usage unique (télécommandes, lampes de poche) | Rentables, largement disponibles |
| Piles secondaires | Appareils rechargeables (téléphones, ordinateurs portables) | Réutilisables, longue durée de vie |
| Batteries lithium-ion | Électronique portable, véhicules électriques | Densité énergétique élevée, faible autodécharge |
| Piles à combustible | Véhicules électriques, alimentation de secours, espace | Rendement élevé, faible pollution, évolutivité |
Produits associés
- Potentiostat de poste de travail électrochimique de laboratoire pour une utilisation en laboratoire
- Électrode à disque d'or
- Électrode Électrochimique en Feuille d'Or Électrode en Or
- Fixation d'électrode pour expériences électrochimiques
- Cellule électrolytique de type H Triple Cellule électrochimique
Articles associés
- Guide complet des analyseurs portatifs de piles au lithium : Caractéristiques, applications et maintenance
- Guide complet des électrodes de référence : Types, applications et critères de sélection
- Exploration du bain-marie multifonctionnel pour cellules électrolytiques : Applications et avantages
- Comprendre les électrodes de référence au calomel saturé : Composition, utilisations et considérations
- L'Architecture de la Certitude : Maîtriser le Contrôle dans les Cellules Électrolytiques Multifonctionnelles













