En laboratoire, nous sommes souvent obsédés par la chimie. Nous contrôlons méticuleusement la concentration de l'électrolyte, la pureté du catalyseur et la tension appliquée.
Pourtant, nous négligeons fréquemment les contraintes physiques qui contiennent cette chimie.
Il existe un danger spécifique dans la science expérimentale : supposer que parce que vous avez mesuré quelque chose, le chiffre est réel. Mais un chiffre sans contexte n'est que du bruit.
Dans les cellules électrochimiques, la différence entre le bruit et le signal se résume souvent à une seule dimension physique : la zone de réaction.
La standardisation du chaos
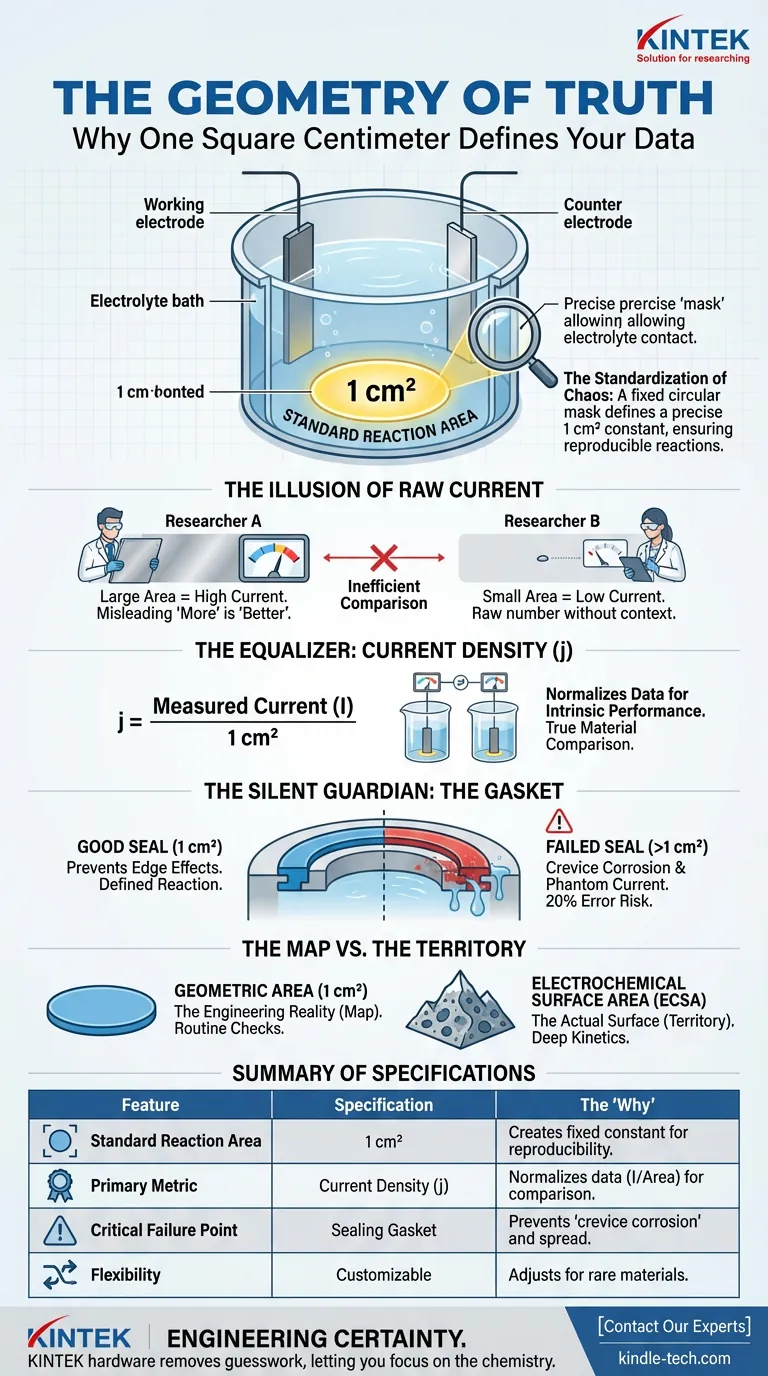
La cellule électrolytique en question comporte un trou circulaire fixe à la base. Ce n'est pas un choix de conception arbitraire. C'est un contrôle technique précis.
Ce trou définit une zone de réaction standard de 1 centimètre carré (1 cm²).
Pourquoi 1 cm² ? Parce que dans un monde de variables infinies, il faut une constante. Cette ouverture définie agit comme un masque, ne permettant à l'électrolyte de toucher qu'une partie spécifique et connue de votre électrode de travail.
Sans ce masque, votre réaction se propage. Elle devient indéfinie. Et une réaction indéfinie ne peut pas être répétée.
L'illusion du courant brut
Imaginez deux chercheurs testant le même catalyseur.
- Le chercheur A utilise une grande feuille de métal.
- Le chercheur B utilise une minuscule poussière.
Le chercheur A mesurera un courant plus élevé à chaque fois. Cela signifie-t-il que son catalyseur est meilleur ? Non. Cela signifie simplement qu'il en a utilisé davantage.
C'est là que la psychologie des chiffres nous trompe. "Plus" semble être "mieux", mais en électrochimie, l'efficacité est reine.
L'égaliseur : la densité de courant
Pour comparer des choses comparables, nous devons passer du courant brut (Ampères) à la densité de courant (Ampères/cm²).
Les mathématiques sont simples, mais l'implication est profonde :
Densité de courant (j) = Courant mesuré (I) / 1 cm²
En fixant le dénominateur (la surface) à exactement 1 cm², la cellule force les données à refléter les performances *intrinsèques* du matériau, et non la taille de l'échantillon découpé.
Le gardien silencieux : le joint
Le défi technique n'est pas seulement de découper un trou de 1 cm². Il s'agit de le sceller.
Entre le corps de la cellule et votre échantillon se trouve un joint. Ce modeste composant est la seule chose qui empêche l'électrolyte de s'infiltrer sur les côtés.
Si ce joint échoue, deux choses se produisent :
- Effets de bord : La densité de réaction augmente au périmètre, faussant les données.
- Corrosion caverneuse : La chimie se produit dans les interstices cachés, ajoutant un "courant fantôme" à votre lecture.
Un joint usé transforme une expérience de 1 cm² en une estimation de 1,2 cm². En cinétique de précision, cette erreur de 20 % fait la différence entre une découverte et une hypothèse échouée.
La carte contre le territoire
Il existe une dernière couche de complexité : la différence entre la carte (surface géométrique) et le territoire (surface électrochimique).
La surface géométrique est le cercle plat de 1 cm² défini par le matériel. C'est la carte standard que nous utilisons pour la comparaison.
Cependant, si vous zoomez, votre électrode peut être une éponge poreuse ou une chaîne de montagnes rugueuse. La surface électrochimique (ECSA) est la surface réelle de ces montagnes.
- Pour les vérifications de routine : Utilisez la surface géométrique de 1 cm². Elle représente la réalité technique.
- Pour une cinétique approfondie : Vous devez calculer l'ECSA, mais vous avez toujours besoin de la surface géométrique comme contrôle de base.
Résumé des spécifications
Le tableau suivant détaille la relation critique entre le matériel et les données :
| Caractéristique | Spécification | Le "Pourquoi" |
|---|---|---|
| Zone de réaction standard | 1 cm² | Crée une constante géométrique fixe pour la reproductibilité. |
| Métrique principale | Densité de courant | Normalise les données (I / Surface) pour permettre la comparaison des matériaux. |
| Point de défaillance critique | Joint d'étanchéité | Prévient la "corrosion caverneuse" et la propagation indéfinie de la réaction. |
| Flexibilité | Personnalisable | Permet des ajustements pour les matériaux rares ou à faible conductivité. |
Ingénierie de la certitude
Chez KINTEK, nous comprenons que la grande science repose sur du matériel fiable.
Nos cellules électrolytiques sont conçues avec une zone de réaction de 1 cm² usinée avec précision pour éliminer les approximations dans vos calculs. Nous concevons les contraintes pour que vous puissiez vous concentrer sur la chimie.
Ne laissez pas les variables physiques devenir des erreurs expérimentales.
Guide Visuel
Produits associés
- Fabricant personnalisé de pièces en PTFE Téflon pour cylindre gradué en PTFE 10/50/100ml
- Machine automatique de presse hydraulique de pastilles de laboratoire pour usage en laboratoire
- Mélangeur rotatif à disque de laboratoire pour un mélange et une homogénéisation efficaces des échantillons
- Trancheuse de laboratoire manuelle
- Fabricant personnalisé de pièces en PTFE Téflon pour tamis en maille F4 en PTFE
Articles associés
- Guide complet des presses à granulés de laboratoire chauffées manuelles intégrées
- Presses hydrauliques manuelles pour laboratoire : Un guide complet
- Le rôle clé du PTFE dans la fabrication des semi-conducteurs : des gazoducs à l'isolation électrique
- Application innovante du PTFE dans les garnitures mécaniques
- Exploration du bain-marie multifonctionnel pour cellules électrolytiques : Applications et avantages





