Introduction aux électrodes de référence
Définition et fonction
Une électrode de référence est un élément essentiel des études électrochimiques, car elle sert de repère pour mesurer la différence de potentiel par rapport à une électrode d'étude. Cette mesure est essentielle pour évaluer avec précision le comportement de l'électrode d'étude dans diverses conditions. Généralement, le potentiel d'une électrode de référence est mesuré par rapport à une électrode d'hydrogène standard réversible (RHE). électrode standard réversible à l'hydrogène (RHE) qui est considérée comme l'étalon universel en raison de son potentiel stable et bien défini.

Le rôle de l'électrode de référence va au-delà de la simple mesure ; elle assure la cohérence et la fiabilité des données électrochimiques. En fournissant un potentiel stable et connu, elle permet des comparaisons précises entre différentes expériences et conditions. Cette stabilité est cruciale dans des domaines tels que les études sur la corrosion, la recherche sur les batteries et la surveillance de l'environnement, où même des variations mineures de potentiel peuvent avoir un impact significatif sur les résultats.
Dans les applications pratiques, l'électrode de référence doit répondre à des critères spécifiques pour garantir son efficacité. Elle doit présenter un potentiel connu et stable connu et stable dans le temps et dans des conditions variables, ce qui garantit la cohérence des mesures. En outre, l'électrode doit être réversible ce qui signifie qu'elle peut subir des processus d'oxydation et de réduction sans modifier ses propriétés fondamentales. L'électrolyte de l'électrode de référence doit également être chimiquement inerte, afin d'éviter toute réaction indésirable avec l'électrolyte de la cellule d'électrolyse ou d'autres substances connexes.
Par exemple, dans une configuration typique, l'électrode de référence peut être associée à une électrode Ag/AgCl. électrode Ag/AgCl ou une électrode Hg/Hg2SO4 chacune avec sa solution électrolytique spécifique. Ces combinaisons garantissent que l'électrode de référence conserve sa stabilité et sa précision, fournissant des données fiables pour les mesures de potentiel de l'électrode d'étude.
Conditions d'une bonne électrode de référence
Une électrode de référence doit présenter plusieurs caractéristiques essentielles pour fonctionner efficacement dans les études électrochimiques. Tout d'abord, elle doit maintenir un potentiel connu et stable tout au long de son utilisation. Cette stabilité garantit que les mesures de potentiel effectuées sont fiables et cohérentes, ce qui est crucial pour la collecte de données précises.
Deuxièmement, l'électrode doit être réversible c'est-à-dire qu'elle peut subir des réactions d'oxydation et de réduction sans changement significatif de son potentiel. Cette réversibilité est essentielle pour maintenir l'intégrité de l'électrode et garantir qu'elle peut être utilisée de manière répétée sans dégradation.
En outre, l électrolyte de l'électrode de référence doit être choisi avec soin. Il ne doit pas réagir chimiquement avec l'électrolyte de la cellule d'électrolyse ou toute autre substance apparentée. De telles réactions pourraient modifier le potentiel de l'électrode et entraîner des mesures erronées. Par exemple, si l'électrolyte de l'électrode de référence réagit avec la solution de l'échantillon, il peut provoquer un déplacement du potentiel de référence, ce qui compromet la précision des mesures.
En outre, l'électrode de référence doit être compatible avec l'échantillon mesuré . Cette compatibilité garantit qu'il n'y a pas d'interactions chimiques indésirables entre l'échantillon et l'électrolyte, qui pourraient affecter la stabilité du potentiel de l'électrode. Par exemple, certains produits chimiques présents dans l'échantillon peuvent dégrader le matériau de l'électrode, ce qui nécessite la sélection de matériaux appropriés tels que le verre, l'époxy ou d'autres substances adéquates.
Dans les applications pratiques, il est souvent plus efficace d'utiliser une électrode de détection (demi-cellule) séparée. électrode de détection (demi-cellule) et de référence séparées si l'on s'attend à ce que les différentes parties de l'électrode aient des durées de vie différentes. Cette séparation permet de remplacer plus facilement les composants usés sans avoir à mettre au rebut l'ensemble de l'électrode. En outre, dans certaines applications spécialisées, l'utilisation d'une électrode de référence séparée est non seulement pratique, mais aussi nécessaire pour obtenir la précision et l'efficacité souhaitées.
Par exemple, en voltampérométrie cyclique (CV), l'utilisation d'un simple fil d'Ag plongé directement dans la solution d'analyte comme électrode de référence est théoriquement possible mais n'est pas recommandée. La perte lente d'ions Ag+ pourrait interagir avec l'analyte, et tout changement dans la solution électrolytique pourrait modifier le potentiel de référence. La meilleure pratique consiste à isoler l'électrode de référence de la solution à analyser à l'aide d'une fritte en vycor (verre poreux). Cette configuration maintient le contact électrique tout en minimisant le mélange des solutions, préservant ainsi la stabilité du potentiel de référence.
Il faut également veiller à ce que la fritte vycor ne se dessèche pas, car le sel de l'électrolyte peut alors se cristalliser dans les pores, ce qui rend l'électrode inutilisable. Des contrôles réguliers, par exemple en essayant de presser du liquide à travers la fritte à l'aide d'une poire à pipette, permettent de s'assurer de son intégrité. Les électrodes de référence Ag/AgCl aqueuses disponibles dans le commerce doivent être stockées dans l'obscurité et immergées dans des solutions identiques à la solution à l'intérieur de l'électrode de référence, généralement du KCl saturé. Avec le temps, les électrodes Ag/AgCl peuvent développer une accumulation blanche sur le fil et dériver de leur potentiel de référence annoncé, ce qui nécessite une surveillance attentive et un remplacement si nécessaire.
En résumé, une bonne électrode de référence doit combiner stabilité, réversibilité et compatibilité chimique pour fournir des mesures de potentiel fiables et précises dans les expériences électrochimiques.
Étalonnage et correction des électrodes de référence

Processus d'étalonnage
L'étalonnage d'une électrode de référence est un processus méticuleux qui garantit la précision et la fiabilité des mesures de potentiel dans les études électrochimiques. La procédure consiste généralement à mettre en place un système à trois électrodes, dans lequel l'électrode de référence à étalonner sert d'électrode de travail. Le système est complété par l'incorporation d'une électrode Ag/AgCl comme électrode de référence et d'une électrode de platine (Pt) comme contre-électrode.
Pour obtenir un étalonnage précis, la méthode de test de contrôle du potentiel en circuit ouvert est utilisée. Cette méthode consiste à surveiller le potentiel de l'électrode de travail dans le temps jusqu'à l'obtention d'une lecture stable. La stabilité de la courbe de potentiel est cruciale, car elle indique que l'électrode de référence fonctionne correctement et de manière cohérente.
| Composant | Rôle dans l'étalonnage |
|---|---|
| Électrode de travail | Électrode de référence testée |
| Électrode de référence | Électrode Ag/AgCl |
| Contre-électrode | Électrode Pt |
La méthode de contrôle du potentiel en circuit ouvert est particulièrement avantageuse car elle permet d'identifier toute dérive ou instabilité du potentiel de l'électrode de référence. Cette méthode est non invasive et ne nécessite pas de courant externe, ce qui en fait un choix idéal pour maintenir l'intégrité de l'environnement de l'électrode de référence pendant l'étalonnage.
En résumé, le processus d'étalonnage d'une électrode de référence est une étape critique pour garantir la précision des mesures électrochimiques. En utilisant un système à trois électrodes et en employant la méthode de test de contrôle du potentiel en circuit ouvert, les chercheurs peuvent obtenir une courbe de potentiel stable et fiable, validant ainsi la performance de l'électrode de référence.
Formule de correction
Le potentiel réel de l'électrode de référence peut être déterminé avec précision à l'aide d'une formule de correction spécifique. Cette formule, exprimée sous la forme ( E_X = x - 0,197 ), est essentielle pour garantir la précision et la fiabilité des mesures électrochimiques. Dans cette équation, ( x ) représente le potentiel mesuré de l'électrode de référence, tandis que la constante 0,197 correspond au potentiel connu de l'électrode Ag/AgCl.
Pour comprendre l'importance de cette correction, il est important de reconnaître que l'électrode Ag/AgCl sert de référence standard dans de nombreuses expériences électrochimiques. Son potentiel stable et bien documenté permet un étalonnage cohérent dans différentes configurations. En soustrayant le potentiel de l'électrode Ag/AgCl de la valeur mesurée, les chercheurs peuvent obtenir le véritable potentiel de leur électrode de référence, éliminant ainsi les divergences potentielles et améliorant la précision de leurs données.
Ce processus de correction est particulièrement crucial dans les expériences où des variations même mineures du potentiel de l'électrode peuvent avoir un impact significatif sur les résultats. Par conséquent, la formule ( E_X = x - 0,197 ) n'est pas seulement un ajustement mathématique, mais une étape critique dans le maintien de l'intégrité des mesures électrochimiques.
Électrodes de référence couramment utilisées
Électrode Hg/Hg₂SO₄
L'électrode Hg/Hg₂SO₄ est constituée d'un amalgame solide de mercure et de sulfate de mercure(I), encapsulé dans une solution d'ions sulfate. Plus précisément, la configuration de l'électrode est représentée comme suit Hg/Hg₂SO₄(solide)/SO₄²- et elle est généralement immergée dans une solution de sulfate 0,1M. Cette configuration garantit un potentiel stable et bien défini, ce qui en fait une référence fiable dans diverses applications électrochimiques.
Contrairement à d'autres électrodes de référence, telles que l'électrode au chlorure d'argent-argent, qui repose sur la précipitation d'AgCl dans l'électrolyte, l'électrode Hg/Hg₂SO₄ tire parti de l'interaction à l'état solide entre le mercure et son composé de sulfate. Cette structure unique fournit non seulement une base solide pour la mesure du potentiel, mais minimise également le risque de contamination ou d'instabilité, qui peut être courant dans les électrodes qui impliquent des interfaces liquide-liquide.
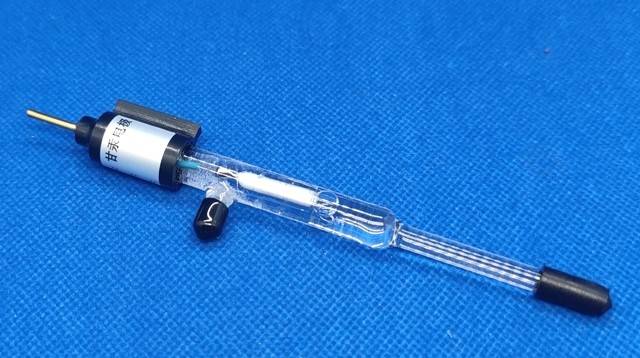
L'utilisation d'une solution de sulfate à 0,1 M améliore encore les performances de l'électrode en maintenant un environnement ionique cohérent autour de l'amalgame de mercure. Cette concentration est soigneusement choisie pour équilibrer le besoin d'une mobilité ionique suffisante avec l'exigence d'une interférence minimale de l'électrolyte. Par conséquent, l'électrode Hg/Hg₂SO₄ reste un choix populaire pour les applications où la haute précision et la stabilité à long terme sont primordiales.
Électrode d'acide mercurique saturée
L'électrode à acide mercurique saturé (SMAE) est un composant essentiel des études électrochimiques, particulièrement connu pour sa structure composée de mercure (Hg), de chlorure mercureux (Hg₂Cl₂, également connu sous le nom de calomel) et d'une solution saturée de chlorure de potassium (KCl). Cette électrode est conçue pour maintenir un potentiel stable et reproductible, ce qui est essentiel pour des mesures précises dans diverses expériences électrochimiques.
La structure de la SMAE est simple mais très efficace. Elle se compose d'un bassin de mercure au fond duquel est déposée une couche de calomel solide. Cette couche de calomel sert d'intermédiaire entre le mercure et la solution électrolytique. La solution de KCl saturée intégrée garantit que l'électrode reste dans un état d'équilibre, fournissant un potentiel de référence constant.
L'un des principaux avantages de la SMAE est sa capacité à fonctionner dans un environnement de KCl saturé, ce qui permet de maintenir une concentration élevée d'ions chlorure. Cette saturation est cruciale car elle minimise les fluctuations de potentiel et garantit un potentiel de référence stable sur de longues périodes, ce qui le rend particulièrement adapté aux expériences à long terme.
En résumé, la conception du SMAE, avec sa structure Hg/Hg₂Cl₂(solide)/KCl et l'utilisation d'une solution de KCl saturée, offre un potentiel de référence robuste et fiable, ce qui en fait un choix privilégié dans de nombreuses applications électrochimiques.
Électrode argent/chlorure d'argent
L'électrode argent/chlorure d'argent (Ag/AgCl) est une électrode de référence largement utilisée en raison de sa rentabilité et de sa toxicité réduite par rapport à d'autres électrodes de référence telles que l'électrode de Calomel. Cette électrode est composée d'un fil d'argent (Ag) recouvert d'une couche de chlorure d'argent solide (AgCl), qui est ensuite immergé dans une solution saturée en chlorure de potassium (KCl) et en chlorure d'argent (AgCl). La structure de l'électrode peut être représentée par Ag/AgCl(solide)/KCl.
L'électrode fonctionne sur la base de la demi-réaction suivante :
$$ \text{AgCl(s)} + \text{e}^- \leftrightarrow \text{Ag(s)} + \text{Cl}^-(\text{sat'd}) $$
À 25°C, cette réaction donne un potentiel de 0,197 V par rapport à l'électrode standard à hydrogène (SHE). Cette valeur s'écarte légèrement du potentiel de l'électrode standard (E0) de 0,222 V en raison de la contribution du KCl et de l'AgCl à l'activité chlorure, qui n'est pas exactement unitaire.
L'électrode Ag/AgCl est privilégiée pour plusieurs raisons :
- Stabilité: Elle maintient un potentiel de demi-cellule stable dans le temps.
- Dépendance à la température: Le potentiel change d'environ 0,5 - 1,0 mV/°C, ce qui est relativement minime.
- Solution saturée: La perte d'électrolyte par évaporation ne modifie pas la nature saturée de la solution, préservant ainsi le potentiel de l'électrode.
Une représentation schématique de l'électrode de référence Ag/AgCl est souvent illustrée pour permettre une compréhension visuelle claire de sa construction et de son fonctionnement.
Électrode de mercure/oxyde de mercure
L'électrode de mercure/oxyde de mercure (électrode MMO) est un composant essentiel des études électrochimiques, caractérisé par sa structure unique. Cette électrode est composée d'une couche métallique de mercure (Hg) en contact direct avec une couche solide d'oxyde de mercure (HgO), le tout immergé dans une solution concentrée d'hydroxyde de potassium (KOH). Plus précisément, la solution intégrée est généralement une solution de KOH 1M, qui joue un rôle essentiel dans le maintien de la stabilité et des performances de l'électrode.
L'électrode MMO est particulièrement appréciée pour sa capacité à fournir un potentiel stable et reproductible, ce qui en fait un choix idéal pour diverses applications électrochimiques. La solution de KOH assure non seulement la fonctionnalité de l'électrode, mais contribue également à prévenir la contamination et à maintenir la longévité de l'électrode. Cette configuration permet à l'électrode MMO de servir efficacement d'électrode de référence, offrant des lectures de potentiel cohérentes qui sont cruciales pour des mesures électrochimiques précises.
En résumé, l'électrode de mercure/oxyde de mercure se distingue par sa structure robuste et l'utilisation d'une solution de KOH 1M, qui contribuent collectivement à sa fiabilité et à son efficacité dans la recherche électrochimique.
Sélection et entretien des électrodes de référence
Critères de sélection
Lors de la sélection d'une électrode de référence, il est essentiel de s'assurer que la solution intégrée correspond au système de recherche afin d'éviter toute contamination potentielle. Cette adéquation est essentielle car l'électrolyte de l'électrode de référence ne doit pas réagir avec l'électrolyte de la cellule d'électrolyse ou des substances apparentées, ce qui pourrait compromettre la précision de vos mesures.
Par exemple, lorsque vous travaillez avec du H₂SO₄ solutions l'indicateur électrode Hg/Hg₂SO₄ est le choix idéal. Cette électrode, avec sa structure Hg/Hg₂SO₄(solide)/SO₄²-, est équipée d'une solution intégrée de sulfate 0,1M, ce qui la rend parfaitement adaptée aux environnements d'acide sulfurique. En revanche, pour les solutions de chlorure l'électrode électrode Ag/AgCl est l'option préférée. Cette électrode, structurée comme Ag/AgCl(solide)/KCl, comprend une solution intégrée de KCl 0,1M, ce qui est optimal pour les systèmes de recherche basés sur les chlorures.
| Type de solution | Électrode recommandée | Structure de l'électrode | Solution intégrée |
|---|---|---|---|
| Solutions de H₂SO₄ | Électrode Hg/Hg₂SO₄ (solide) /SO₄ (solide) | Hg/Hg₂SO₄(solide)/SO₄²- | Solution de sulfate 0,1M |
| Solutions de chlorure | Électrode Ag/AgCl | Ag/AgCl(solide)/KCl | Solution de KCl 0,1M |
En adaptant soigneusement l'électrode de référence au type de solution, vous pouvez réduire considérablement le risque de contamination et garantir des mesures électrochimiques plus fiables et plus précises.
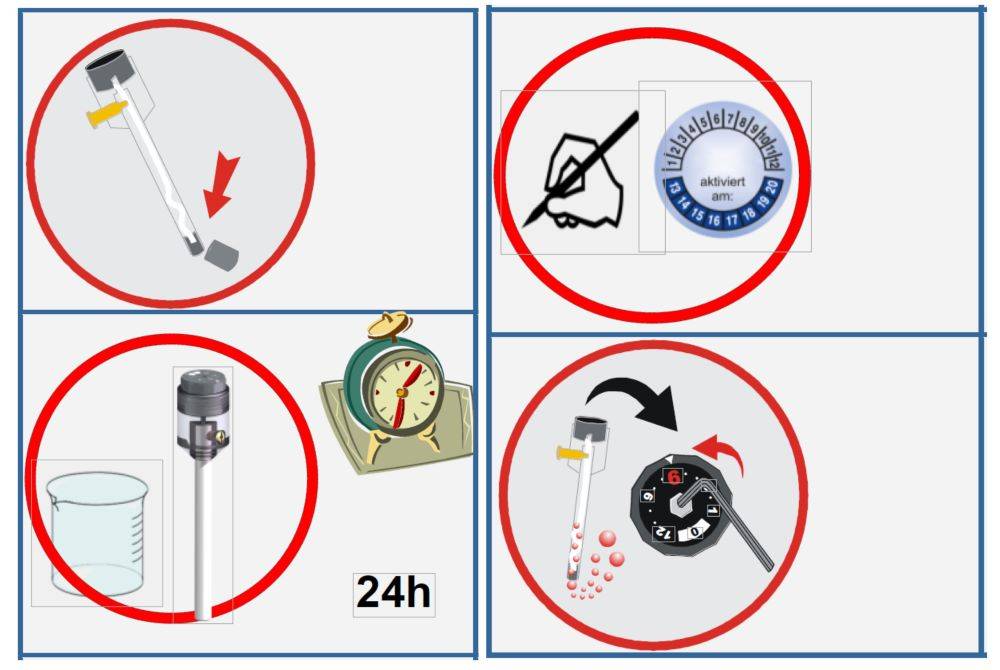
Conseils d'entretien
Il est essentiel d'entretenir correctement les électrodes de référence pour préserver leur précision et leur longévité. Pour garantir des performances optimales, suivez ces conseils d'entretien essentiels :
-
Conditions de stockage: Stocker l'électrode de référence à température ambiante pour éviter les fluctuations potentielles dues à des températures extrêmes. En outre, protégez l'électrode de la lumière directe pour éviter toute dégradation des matériaux.
-
Gestion de la solution de remplissage: Remplacer régulièrement la solution de remplissage pour maintenir la stabilité du potentiel de l'électrode. La fréquence de remplacement dépend du taux d'utilisation, mais il est généralement conseillé de vérifier et de remplacer la solution toutes les quelques semaines pour garantir la cohérence.
-
Prévention des bulles d'air: Veillez à ce qu'il n'y ait pas de bulles d'air dans la solution intégrée. Les bulles d'air peuvent interférer avec les performances de l'électrode en créant une barrière qui perturbe la connexion électrique. Inspectez régulièrement la solution et tapotez doucement l'électrode pour éliminer l'air emprisonné.
En respectant ces pratiques d'entretien, vous pouvez améliorer considérablement la fiabilité et la durée de vie de vos électrodes de référence, ce qui vous permettra d'obtenir des résultats précis et cohérents lors de vos études électrochimiques.
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode à disque d'or
- Cellule électrochimique de corrosion plane
- Matériau de polissage d'électrodes pour expériences électrochimiques
Articles associés
- Principe de fonctionnement et applications de l'électrode de référence AgAgCl
- Comment fabriquer votre propre électrode de référence Ag/AgCl pour des expériences électrochimiques
- Un guide complet des électrodes de référence
- Comment choisir la bonne électrode de référence pour votre application
- Électrodes de référence : Calomel, chlorure d'argent et sulfate de mercure - Un guide complet















