En génie chimique, l'augmentation de la pression dans un réacteur est fondamentalement obtenue en manipulant les variables de la loi des gaz parfaits (PV=nRT). Les méthodes les plus courantes consistent à introduire plus de matière (gaz), à augmenter la température du système ou à réduire mécaniquement le volume du réacteur. Chaque méthode a un but distinct et a des implications significatives pour la cinétique de la réaction, l'équilibre et la sécurité globale.
Le défi principal n'est pas simplement comment augmenter la pression, mais pourquoi vous le faites. Le choix de la bonne méthode dépend entièrement de l'objectif : augmenter la concentration des réactifs, déplacer l'équilibre chimique ou contrôler la phase des matériaux à l'intérieur du réacteur.

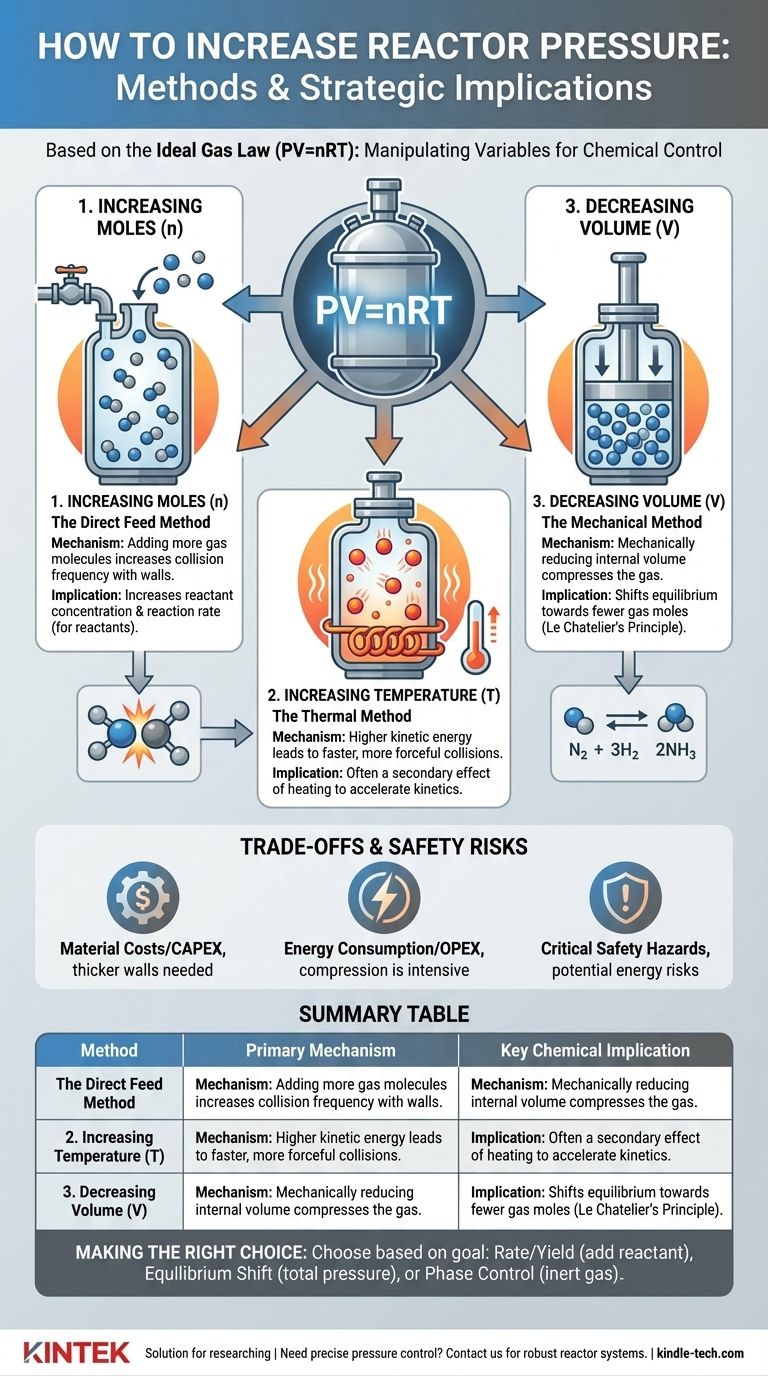
Les principes fondamentaux de la génération de pression
À la base, la pression est le résultat des collisions des molécules de gaz avec les parois d'un récipient. Pour augmenter cette pression, vous devez rendre ces collisions plus fréquentes ou plus énergiques. La loi des gaz parfaits fournit le cadre théorique pour y parvenir.
Augmenter le nombre de moles (n) : La méthode d'alimentation directe
C'est l'approche la plus simple. En ajoutant plus de molécules de gaz dans un volume fixe, vous augmentez le nombre de collisions avec les parois du réacteur, ce qui élève la pression.
Cependant, il existe une distinction cruciale entre l'ajout d'un réactif et l'ajout d'un gaz inerte. L'ajout d'un réactif gazeux augmente sa pression partielle, ce qui augmente directement sa concentration et peut accélérer la vitesse de réaction.
Inversement, l'ajout d'un gaz inerte (comme l'azote ou l'argon) augmente la pression totale du système mais ne modifie pas les pressions partielles des réactifs. Cette technique est souvent utilisée pour contrôler le comportement de phase ou pour la gestion de la chaleur, et non pour influencer directement la vitesse de réaction.
Augmenter la température (T) : La méthode thermique
Le chauffage d'un réacteur scellé augmente l'énergie cinétique des molécules de gaz à l'intérieur. Ces molécules énergisées se déplacent plus rapidement, ce qui entraîne des collisions plus fréquentes et plus énergiques avec les parois du réacteur, ce qui se manifeste par une augmentation de la pression.
Cette méthode est souvent un effet secondaire de l'exécution d'une réaction à une température plus élevée pour augmenter sa vitesse. L'augmentation de pression doit être anticipée et gérée dans le cadre de la conception du réacteur.
Diminuer le volume (V) : La méthode mécanique
Pour certains types de réacteurs, la pression peut être augmentée en réduisant mécaniquement le volume interne. Pensez à un piston dans un cylindre comprimant un gaz.
Cette méthode est moins courante pour les réacteurs continus à grande échelle, mais elle est un principe fondamental dans certaines configurations de laboratoire, les processus discontinus et certains types de compresseurs ou de moteurs.
Implications chimiques d'une pression plus élevée
L'augmentation de la pression est un outil puissant utilisé pour influencer et contrôler le résultat d'une réaction chimique. Ce n'est pas seulement un paramètre physique, mais un moteur clé du comportement chimique.
Impact sur la vitesse de réaction
Pour la plupart des réactions en phase gazeuse, l'augmentation de la pression par l'ajout de plus de réactifs rapproche les molécules. Cette concentration plus élevée entraîne des collisions moléculaires plus fréquentes, ce qui se traduit généralement par une vitesse de réaction plus rapide.
Impact sur l'équilibre
Ceci est régi par le principe de Le Chatelier. Si une réaction réversible a un nombre différent de moles de gaz du côté des réactifs et des produits, la modification de la pression déplacera l'équilibre.
L'augmentation de la pression favorisera le côté de la réaction avec moins de moles de gaz. L'exemple classique est le procédé Haber-Bosch pour la synthèse de l'ammoniac (N₂ + 3H₂ ⇌ 2NH₃), où une haute pression est utilisée pour déplacer l'équilibre vers le produit, l'ammoniac.
Impact sur le comportement de phase
La pression est également un outil essentiel pour contrôler l'état physique des substances. Une pression élevée peut empêcher un liquide de bouillir, même à des températures élevées, ce qui est essentiel pour de nombreuses réactions en phase liquide. Elle peut également être utilisée pour liquéfier des gaz pour la séparation ou pour faciliter les réactions qui se produisent à l'interface entre un gaz et un liquide.
Comprendre les compromis et les risques de sécurité
Bien qu'une pression plus élevée puisse offrir des avantages significatifs pour le processus, elle s'accompagne de coûts et de dangers substantiels qui doivent être gérés avec soin.
Coûts des matériaux et de construction
Les réacteurs haute pression exigent des parois en acier plus épaisses, des alliages plus avancés et des joints et raccords hautement spécialisés pour assurer le confinement. Cela augmente considérablement les dépenses d'investissement initiales (CAPEX) d'un projet.
Consommation d'énergie
La compression des gaz à haute pression est un processus extrêmement énergivore. Cela se traduit directement par des dépenses d'exploitation (OPEX) plus élevées et peut avoir un impact significatif sur la viabilité économique d'un processus.
Dangers critiques pour la sécurité
La considération la plus importante est la sécurité. Un système haute pression stocke une énorme quantité d'énergie potentielle. Une rupture ou une défaillance peut entraîner un dégagement catastrophique et explosif.
Tous les systèmes haute pression doivent être équipés de multiples couches de sécurité, y compris des soupapes de décharge de pression, des disques de rupture et des protocoles d'inspection et de maintenance rigoureux pour atténuer ces risques.
Faire le bon choix pour votre objectif
La méthode correcte pour augmenter la pression est dictée par l'objectif spécifique de votre processus chimique.
- Si votre objectif principal est d'augmenter la vitesse de réaction et le rendement : L'ajout direct de plus de réactif gazeux est la stratégie la plus efficace, car il augmente les pressions partielles qui entraînent la réaction.
- Si votre objectif principal est de déplacer un équilibre chimique : L'augmentation de la pression totale du système, soit par compression, soit par l'ajout de réactifs, est fondamentale pour les réactions où le côté produit a moins de moles de gaz.
- Si votre objectif principal est de maintenir une phase liquide au-dessus de son point d'ébullition normal : L'augmentation de la pression totale, souvent avec un gaz inerte, est la clé pour créer les conditions de processus nécessaires.
En fin de compte, le contrôle de la pression du réacteur consiste à manipuler stratégiquement la thermodynamique et la cinétique du système pour atteindre le résultat souhaité en toute sécurité et efficacement.
Tableau récapitulatif :
| Méthode | Mécanisme principal | Implication chimique clé |
|---|---|---|
| Augmentation des moles (n) | Ajout de plus de molécules de gaz | Augmente la concentration des réactifs/la vitesse de réaction |
| Augmentation de la température (T) | Augmentation de l'énergie cinétique moléculaire | Effet secondaire du chauffage pour accélérer les réactions |
| Diminution du volume (V) | Compression mécanique du gaz | Déplace l'équilibre vers moins de moles de gaz |
Besoin d'un contrôle précis de la pression pour vos processus de laboratoire ? KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris des systèmes de réacteurs robustes conçus pour une gestion sûre et efficace de la pression. Nos solutions vous aident à atteindre une cinétique de réaction, un rendement et une sécurité optimaux. Contactez KINTEK dès aujourd'hui pour discuter de la manière dont nous pouvons répondre aux besoins spécifiques de votre laboratoire.
Guide Visuel
Produits associés
- Réacteurs de laboratoire personnalisables à haute température et haute pression pour diverses applications scientifiques
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Autoclave horizontal de laboratoire à haute pression, stérilisateur à vapeur pour usage en laboratoire
- Réacteur Autoclave de Laboratoire Haute Pression pour Synthèse Hydrothermale
- Autoclave à vapeur haute pression de laboratoire vertical pour service de laboratoire
Les gens demandent aussi
- Pourquoi les capteurs de pression de haute précision et les systèmes de contrôle de température sont-ils essentiels à l'équilibre des réactions hydrothermales ?
- Pourquoi les réacteurs SCWG doivent-ils maintenir un taux de chauffage spécifique ? Protégez vos récipients haute pression contre les contraintes thermiques
- Pourquoi les réacteurs tubulaires en alliage à haute résistance sont-ils essentiels pour le HHIP ? Assurer la sécurité et la pureté dans les environnements à haute pression
- Quel rôle joue un réacteur à haute pression dans l'hydrodésoxygénation (HDO) du bio-fioul ? Optimisation approfondie des carburants
- Quelle est la fonction d'un autoclave hydrothermique revêtu de PTFE dans la synthèse des cys-CD ? Obtenir des points de carbone de haute pureté



















