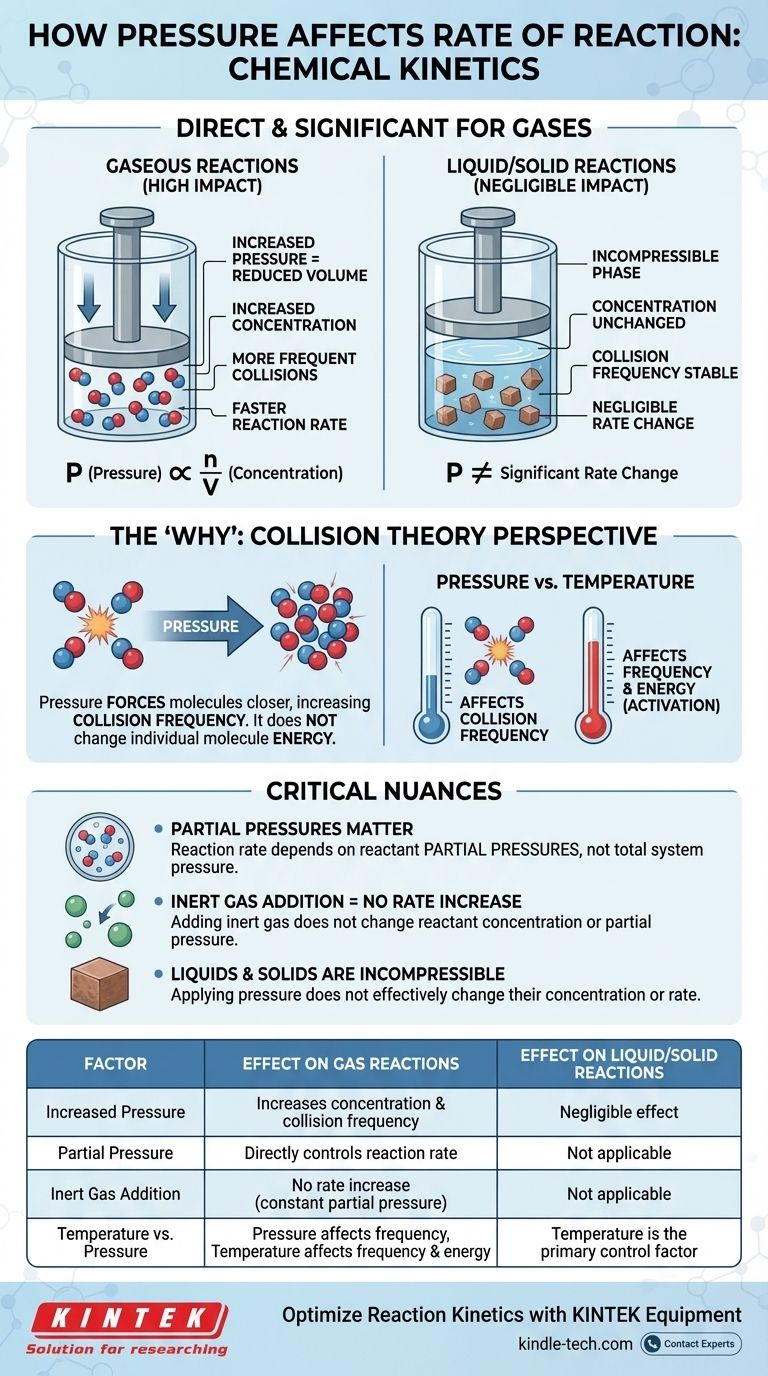
En cinétique chimique, l'effet de la pression sur la vitesse de réaction est direct et significatif, mais uniquement pour les réactions impliquant des gaz. Pour une réaction gazeuse, l'augmentation de la pression augmente la concentration des molécules réactives. Cela entraîne des collisions plus fréquentes entre elles, ce qui, à son tour, augmente la vitesse globale de la réaction. Pour les réactions se produisant purement en phases liquide ou solide, la pression a un effet négligeable sur la vitesse.
La relation entre la pression et la vitesse de réaction est fondamentalement une histoire de concentration. Pour les gaz, l'augmentation de la pression est simplement un moyen physique de forcer plus de molécules dans le même volume, augmentant la fréquence des collisions efficaces et accélérant ainsi la réaction.

Le lien fondamental : la pression comme substitut de la concentration
La raison principale pour laquelle la pression affecte les réactions gazeuses réside dans sa relation directe avec la concentration. Ce principe est mieux expliqué en examinant les lois fondamentales de la chimie.
Le rôle de la loi des gaz parfaits
La loi des gaz parfaits, PV = nRT, fournit le lien mathématique. Si nous la réarrangeons pour résoudre la pression (P = (n/V)RT), nous pouvons voir que la pression (P) est directement proportionnelle à n/V.
Le terme n/V représente les moles (n) par unité de volume (V), ce qui est la définition même de la concentration molaire. Par conséquent, lorsque vous augmentez la pression d'un système à température constante, vous augmentez directement la concentration des molécules de gaz qu'il contient.
Comment la concentration régit la vitesse de réaction
La vitesse d'une réaction est définie par sa loi de vitesse, souvent exprimée comme vitesse = k[A]^m[B]^n. Dans cette équation, [A] et [B] représentent les concentrations des réactifs.
La loi de vitesse montre que la vitesse de réaction dépend directement de la concentration de ses réactifs. Une concentration plus élevée signifie une vitesse plus rapide. En reliant cela à la loi des gaz, la chaîne d'événements devient claire : l'augmentation de la pression augmente la concentration, ce qui à son tour augmente la vitesse de réaction.
Le "pourquoi" du changement : une perspective de la théorie des collisions
Les lois de vitesse nous disent ce qui se passe, mais la théorie des collisions explique pourquoi cela se produit au niveau moléculaire. Pour qu'une réaction se produise, les particules réactives doivent entrer en collision avec une énergie suffisante et une orientation correcte.
Le principe de la fréquence de collision
Une réaction chimique est le résultat d'innombrables collisions moléculaires. Plus il y a de collisions par seconde, plus il y a d'opportunités pour qu'une réaction réussie se produise.
Comment la pression stimule les collisions
L'augmentation de la pression sur un gaz réduit le volume qu'il occupe, forçant les molécules à se rapprocher. Cela augmente considérablement leur fréquence de collision – le nombre de fois qu'elles se heurtent par unité de temps.
Bien que la pression ne modifie pas l'énergie des molécules individuelles (c'est le rôle de la température), elle multiplie le nombre total d'événements de collision. Cette augmentation de fréquence conduit à une augmentation proportionnelle des collisions réussies et provoquant une réaction.
Comprendre les nuances et les compromis
Bien que la règle générale soit valable, un expert doit comprendre les conditions spécifiques dans lesquelles elle s'applique et, plus important encore, quand elle ne s'applique pas.
Le rôle critique des pressions partielles
Dans un mélange de gaz, la vitesse de réaction globale dépend des pressions partielles des réactifs spécifiques, et non de la pression totale du système. La pression partielle est la pression qu'un seul gaz exercerait s'il occupait seul tout le volume.
Cela signifie que vous pouvez augmenter la pression totale en ajoutant un gaz inerte (comme l'argon ou l'azote) au récipient de réaction. Cependant, comme cela ne modifie pas la concentration ou la pression partielle des réactifs réels, cela n'augmentera pas la vitesse de réaction.
L'effet insignifiant sur les liquides et les solides
La pression a un impact négligeable sur les vitesses de réaction dans les phases condensées (liquides et solides). Ces états de la matière sont déjà considérés comme incompressibles.
Les molécules dans les liquides et les solides sont déjà étroitement tassées. L'application d'une pression externe ne diminue pas significativement la distance entre elles ni ne modifie leur concentration. Par conséquent, ce n'est pas un levier efficace pour modifier leurs vitesses de réaction.
Pression vs Température
Il est crucial de distinguer les effets de la pression et de la température.
- La pression affecte principalement la fréquence des collisions.
- La température affecte à la fois la fréquence des collisions (les molécules se déplacent plus vite) et, plus important encore, l'énergie de chaque collision.
L'augmentation de la température augmente la fraction de molécules qui possèdent l'énergie d'activation minimale requise, ce qui en fait un facteur beaucoup plus puissant pour augmenter les vitesses de réaction que la pression.
Faire le bon choix pour votre système
Comprendre ce principe vous permet de contrôler les résultats des réactions en fonction de vos objectifs spécifiques. Tenez compte des points suivants lors de la conception ou de l'optimisation d'un processus chimique.
- Si votre objectif principal est de maximiser la vitesse d'une réaction gazeuse : L'augmentation de la pression du système en réduisant son volume est une méthode directe et efficace pour augmenter le débit.
- Si votre objectif principal est de contrôler une réaction dans un mélange gazeux : Vous devez gérer les pressions partielles des réactifs, car l'ajout simple d'un gaz inerte pour augmenter la pression totale n'accélérera pas votre réaction cible.
- Si votre objectif principal est de modifier la vitesse d'une réaction en phase liquide ou solide : La manipulation de la pression n'est pas une stratégie viable ; vous devriez vous concentrer sur la modification de la température, de la concentration des espèces dissoutes ou l'utilisation d'un catalyseur.
En comprenant que la pression est un substitut de la concentration dans les gaz, vous obtenez un contrôle précis sur la cinétique de votre système.
Tableau récapitulatif :
| Facteur | Effet sur les réactions gazeuses | Effet sur les réactions liquides/solides |
|---|---|---|
| Pression accrue | Augmente la concentration et la fréquence de collision | Effet négligeable (incompressible) |
| Pression partielle | Contrôle directement la vitesse de réaction | Non applicable |
| Ajout de gaz inerte | Pas d'augmentation de la vitesse (pression partielle constante) | Non applicable |
| Température vs Pression | La pression affecte la fréquence ; la température affecte la fréquence et l'énergie | La température est le principal facteur de contrôle |
Besoin de contrôler précisément vos réactions chimiques ? KINTEK est spécialisé dans les équipements de laboratoire de haute qualité, y compris les réacteurs sous pression et les systèmes de manipulation des gaz, pour vous aider à optimiser la cinétique des réactions et à obtenir des résultats supérieurs dans votre laboratoire. Contactez nos experts dès aujourd'hui pour discuter de votre application spécifique et découvrir la solution adaptée à vos besoins.
Guide Visuel
Produits associés
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Mini réacteur autoclave haute pression SS pour utilisation en laboratoire
- Réacteur Autoclave Haute Pression en Acier Inoxydable pour Laboratoire
- Réacteur Autoclave de Laboratoire Haute Pression pour Synthèse Hydrothermale
- Presse isostatique à froid de laboratoire électrique divisée CIP pour pressage isostatique à froid
Les gens demandent aussi
- Pourquoi les autoclaves à haute pression sont-ils essentiels pour la préparation d'agents de durcissement à base de polyamide biosourcé à partir d'acide dimère ?
- Pourquoi les récipients de réaction de laboratoire scellés sont-ils nécessaires dans la synthèse hydrothermale des zéolithes ? Assurer la pureté et le rendement
- Quel rôle joue un autoclave dans la simulation des conditions d'un REP ? Validation avancée des matériaux pour la sécurité nucléaire
- Quelle est la fonction d'un réacteur hydrothermique à température constante ? Maîtriser l'activation des cendres volantes de charbon
- Quel est le but de l'utilisation de gaz d'argon de haute pureté dans un réacteur à haute pression ? Assurer des données précises sur les tests de corrosion



















