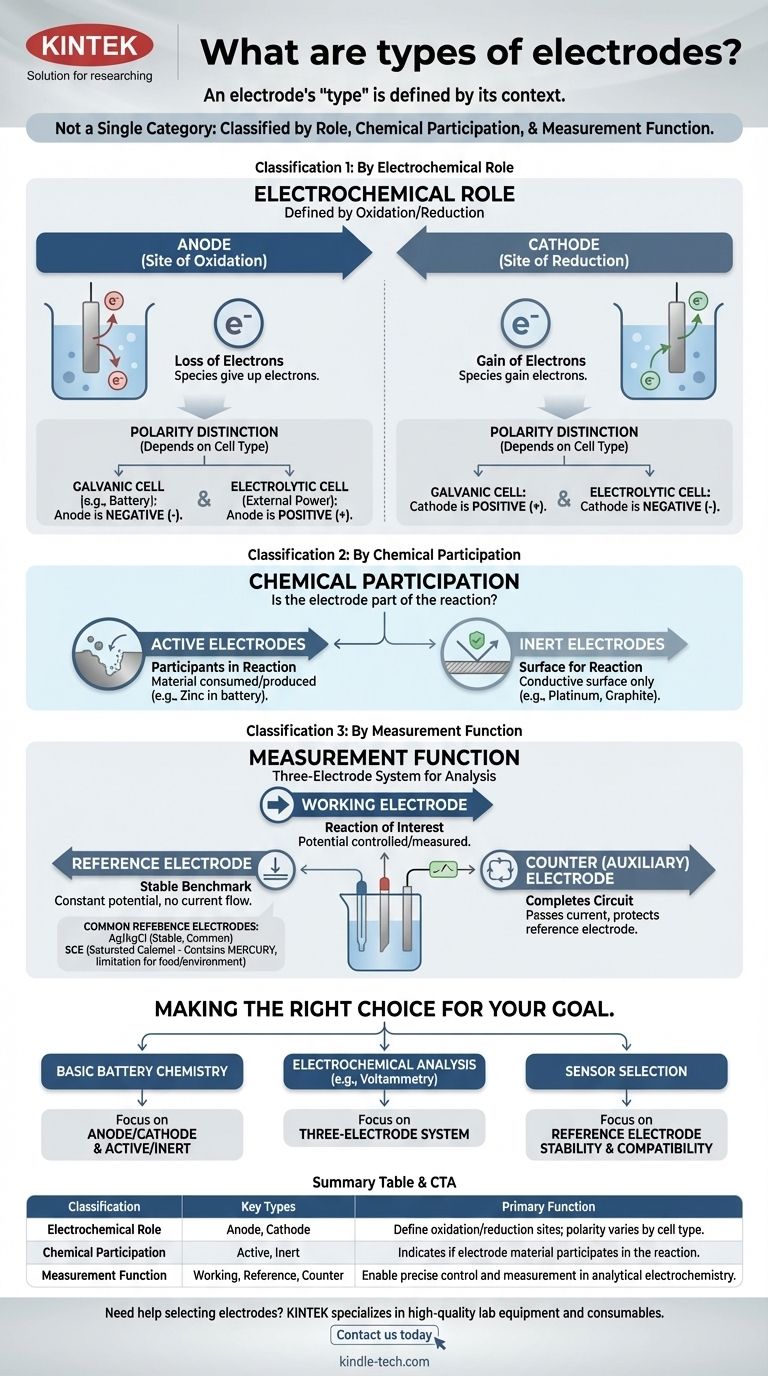
Le terme "électrode" n'est pas une catégorie unique. Au lieu de cela, les électrodes sont classées de plusieurs manières distinctes en fonction de leur rôle dans une réaction, de leur participation chimique et de leur fonction au sein d'un système de mesure. Comprendre ces différents systèmes de classification est la clé pour saisir leur objectif dans toute cellule électrochimique.
L'idée la plus critique est que le "type" d'une électrode est défini par son contexte. La même pièce de métal peut être une anode ou une cathode, active ou inerte, selon entièrement le système électrochimique dans lequel vous la placez.
Classification 1 : Par rôle électrochimique
La classification la plus fondamentale définit une électrode par son rôle dans les deux moitiés d'une réaction électrochimique : l'oxydation et la réduction.
L'anode : Le site de l'oxydation
L'anode est, par définition, l'électrode où se produit l'oxydation — la perte d'électrons. Les espèces à l'anode cèdent leurs électrons à l'électrode.
La cathode : Le site de la réduction
La cathode est l'électrode où se produit la réduction — le gain d'électrons. La cathode donne ses électrons aux espèces en solution.
La distinction critique : Polarité anode/cathode
Un point de confusion courant est la charge (+ ou -) de l'anode et de la cathode. Cette polarité dépend du type de pile :
- Dans une pile galvanique (comme une batterie), la réaction spontanée génère de l'énergie. L'anode est la borne négative, et la cathode est la borne positive.
- Dans une pile électrolytique, une source d'alimentation externe entraîne une réaction non spontanée. L'anode est la borne positive, et la cathode est la borne négative.
Classification 2 : Par participation chimique
Cette classification décrit si le matériau de l'électrode fait lui-même partie de la réaction chimique.
Électrodes actives : Participantes à la réaction
Une électrode active est fabriquée à partir d'un matériau qui est soit consommé, soit produit pendant la réaction de la pile. Par exemple, dans une batterie zinc-cuivre, l'anode de zinc se dissout, participant activement à la demi-réaction d'oxydation.
Électrodes inertes : Une surface pour la réaction
Une électrode inerte ne participe pas à la réaction chimique. Elle sert uniquement de surface conductrice où l'oxydation ou la réduction peut avoir lieu. Le platine et le carbone (graphite) sont des électrodes inertes courantes utilisées pour faciliter les réactions impliquant des gaz ou des ions dissous.
Classification 3 : Par fonction de mesure
En électrochimie analytique, un système à trois électrodes est souvent utilisé pour des mesures précises. Cela donne lieu à une classification fonctionnelle.
L'électrode de travail
C'est l'électrode où se produit la réaction d'intérêt. Son potentiel est la variable principale contrôlée ou mesurée.
L'électrode de référence : Le repère stable
Une électrode de référence fournit un potentiel stable et constant par rapport auquel le potentiel de l'électrode de travail est mesuré. Son propre potentiel ne change pas, quel que soit le courant qui circule ou la composition de la solution en vrac.
L'électrode auxiliaire (ou contre-électrode)
Le seul but de cette électrode est de compléter le circuit électrique. Elle fait passer tout le courant nécessaire à l'électrode de travail, garantissant qu'un courant négligeable circule à travers l'électrode de référence sensible, protégeant ainsi sa stabilité.
Comprendre les compromis : Électrodes de référence courantes
Le choix de l'électrode de référence est essentiel pour des mesures précises et dépend de l'environnement chimique.
Ag/AgCl : Le cheval de bataille courant
L'électrode Argent/Chlorure d'argent (Ag/AgCl) est l'électrode de référence la plus courante. Elle est stable, peu coûteuse et généralement fiable, ce qui en fait un choix par défaut pour de nombreuses solutions aqueuses.
Électrode au calomel saturée (ECS) : L'alternative classique
L'électrode au calomel saturée (ECS) est une norme plus ancienne et très stable. Elle est souvent utilisée dans les situations où la solution échantillon est incompatible avec les ions argent ou chlorure, ce qui pourrait interférer avec l'électrode Ag/AgCl.
Le problème du mercure : Une limitation clé
Le principal inconvénient de l'ECS est qu'elle contient du mercure. Cela la rend inadaptée aux applications impliquant des aliments, des boissons ou des tests environnementaux où la contamination par le mercure est une préoccupation majeure.
Faire le bon choix pour votre objectif
Votre application détermine quelle classification est la plus importante.
- Si votre objectif principal est de comprendre la chimie de base des batteries : Maîtrisez les concepts d'anode/cathode et d'électrodes actives/inertes.
- Si votre objectif principal est d'effectuer des analyses électrochimiques (comme la voltampérométrie) : Le système à trois électrodes (travail, référence, auxiliaire) est le cadre essentiel.
- Si votre objectif principal est de sélectionner un capteur pour un environnement spécifique : Votre principale préoccupation sera la compatibilité chimique et la stabilité de votre électrode de référence, comme le choix entre Ag/AgCl et une alternative.
Comprendre ces classifications qui se chevauchent vous permet de contrôler et d'interpréter le comportement de tout système électrochimique.

Tableau récapitulatif :
| Classification | Types clés | Fonction principale |
|---|---|---|
| Rôle électrochimique | Anode, Cathode | Définir les sites d'oxydation/réduction ; la polarité varie selon le type de pile (galvanique/électrolytique) |
| Participation chimique | Active, Inerte | Indique si le matériau de l'électrode participe à la réaction ou agit uniquement comme surface |
| Fonction de mesure | Travail, Référence, Auxiliaire | Permettre un contrôle et une mesure précis en électrochimie analytique |
Besoin d'aide pour choisir les bonnes électrodes pour les applications électrochimiques de votre laboratoire ? Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements et de consommables de laboratoire de haute qualité, adaptés à vos besoins de recherche. Que vous travailliez sur le développement de batteries, la conception de capteurs ou les mesures analytiques, notre expertise vous garantit d'obtenir les électrodes optimales pour la précision et la performance. Contactez-nous dès aujourd'hui pour discuter de vos exigences et améliorer vos flux de travail électrochimiques !
Guide Visuel
Produits associés
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode à disque d'or
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode auxiliaire en platine pour usage en laboratoire
- Électrode en feuille de platine pour applications de laboratoire et industrielles
Les gens demandent aussi
- Comment prétraiter une électrode en feuille de platine avant utilisation ? Assurer des mesures électrochimiques précises
- Quels avantages les électrodes BDD offrent-elles dans l'électrolyse de Kolbe ? Maximiser la durabilité et l'efficacité électrochimique
- Quelles sont les précautions clés pour une électrode à disque d'or ? Assurez des résultats précis et une longue durée de vie
- Quelle est la signification de la spectroscopie d'impédance électrochimique (SIE) ? Décoder la cinétique et la stabilité des catalyseurs
- Quelle électrode est utilisée comme référence de masse ? Maîtrisez la clé des mesures électrochimiques précises
- Quels sont les inconvénients des électrodes en or ? Les principales limites pour vos projets de laboratoire
- Comment les électrodes en titane doivent-elles être entretenues et nettoyées régulièrement ? Protéger les revêtements et prolonger la durée de vie
- Comment un disque d'électrode en platine doit-il être utilisé lors d'une expérience ? Un guide pour des mesures électrochimiques précises



















