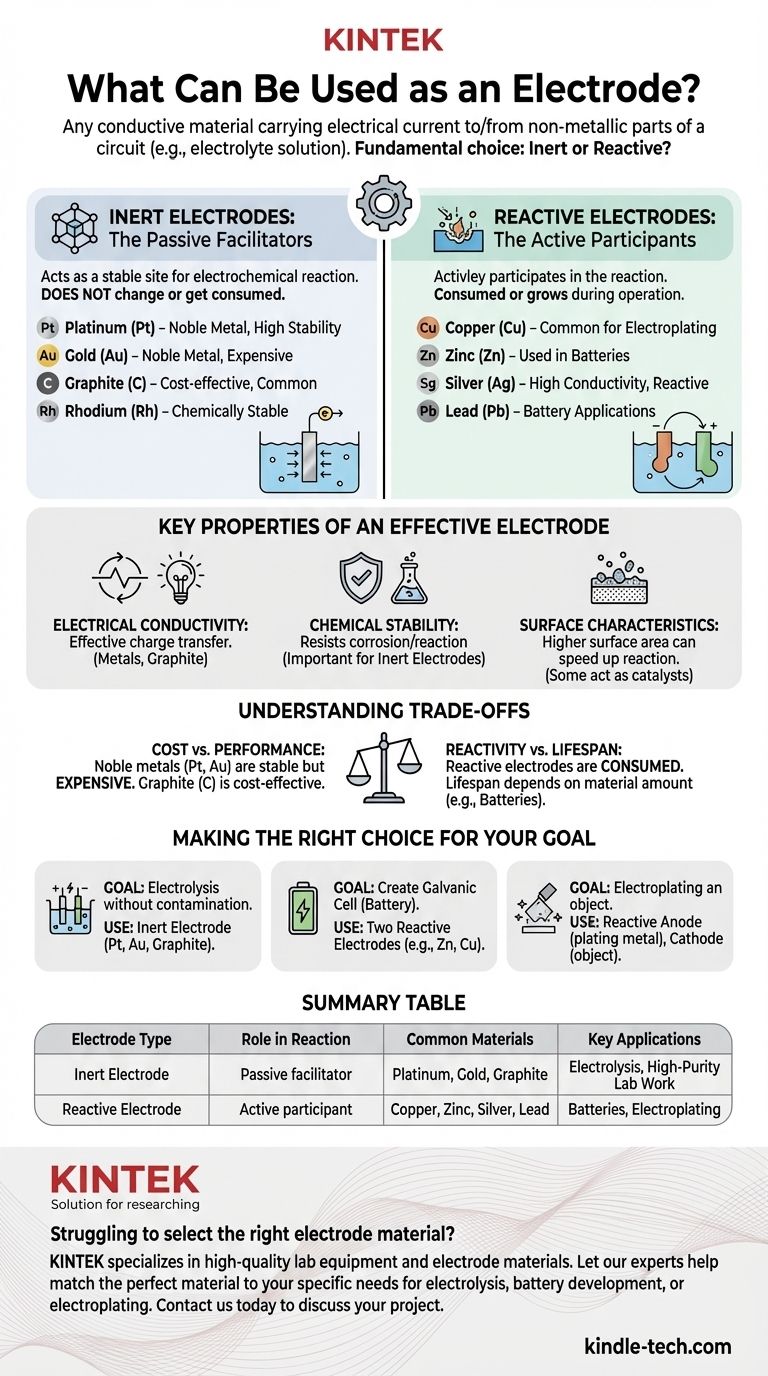
En bref, une électrode est tout matériau conducteur qui transporte un courant électrique vers ou hors d'une partie non métallique d'un circuit, telle qu'une solution électrolytique. Les électrodes sont largement classées en deux catégories : les électrodes inertes, qui ne participent pas à la réaction chimique, et les électrodes réactives, qui y participent. Des exemples courants incluent des métaux comme le platine, l'or, le cuivre et le zinc, ainsi que des non-métaux comme le graphite (carbone).
Le choix d'une électrode est une décision de conception critique dans tout système électrochimique. Le choix fondamental n'est pas seulement « quel matériau conduit l'électricité », mais si vous avez besoin d'un matériau qui reste inchangé (inerte) ou d'un matériau qui participe activement à la réaction chimique (réactif).

Les deux types fondamentaux d'électrodes
La distinction la plus importante lors de la sélection d'un matériau d'électrode est son rôle dans la réaction chimique prévue. Cela sépare tous les matériaux potentiels en deux groupes principaux.
Électrodes inertes : les facilitateurs passifs
Une électrode inerte agit comme un site stable et non réactif pour qu'une réaction électrochimique se produise. Son travail consiste simplement à conduire les électrons vers ou depuis l'électrolyte.
Le matériau lui-même ne change pas, n'est pas consommé ou ne se dissout pas dans la solution. C'est simplement une surface.
Pour cette raison, les électrodes inertes doivent être fabriquées à partir de matériaux chimiquement stables dans l'électrolyte spécifique utilisé. Les choix courants comprennent les métaux nobles et le carbone.
Exemples d'électrodes inertes :
- Platine (Pt)
- Or (Au)
- Graphite (C)
- Rhodium (Rh)
Électrodes réactives : les participants actifs
Une électrode réactive est un participant actif à la réaction électrochimique. Elle est soit oxydée (se dissolvant dans l'électrolyte), soit le produit de la réduction (se déposant à la surface).
Ces matériaux sont choisis spécifiquement pour leur capacité à réagir de manière contrôlée. C'est le principe derrière les batteries et l'électrodéposition.
L'électrode elle-même est consommée ou croît pendant le fonctionnement de la cellule électrochimique.
Exemples d'électrodes réactives :
- Cuivre (Cu)
- Zinc (Zn)
- Argent (Ag)
- Plomb (Pb)
Propriétés clés d'une électrode efficace
Au-delà de la classification de base, plusieurs propriétés déterminent l'efficacité d'un matériau en tant qu'électrode pour un usage spécifique.
Conductivité électrique
C'est l'exigence la plus fondamentale. Le matériau doit être un conducteur d'électricité efficace pour transférer la charge entre le circuit externe et l'électrolyte. Les métaux et le graphite sont d'excellents choix pour cette raison.
Stabilité chimique
Pour qu'une électrode soit considérée comme inerte, elle doit résister à la corrosion ou à la réaction avec l'électrolyte et toute substance produite pendant la réaction. C'est pourquoi les métaux nobles comme le platine et l'or sont très appréciés pour ces applications.
Caractéristiques de surface
La réaction se produit à la surface de l'électrode. Un matériau avec une surface plus grande peut souvent supporter une vitesse de réaction plus rapide. De plus, certains matériaux, comme le platine, peuvent agir comme catalyseurs, abaissant l'énergie nécessaire pour qu'une réaction se produise.
Comprendre les compromis
L'électrode théoriquement « meilleure » n'est pas toujours la plus pratique à utiliser. Les applications du monde réel exigent un équilibre entre la performance et d'autres facteurs.
Coût par rapport à la performance
Les métaux nobles comme le platine et l'or sont des électrodes inertes exceptionnelles en raison de leur stabilité extrême, mais ils sont très coûteux.
Pour de nombreuses applications, le graphite offre une alternative beaucoup plus rentable. Bien qu'il puisse être moins durable ou moins catalytiquement actif que le platine, son faible coût en fait le choix dominant pour d'innombrables processus industriels.
Réactivité par rapport à la durée de vie
Par définition, les électrodes réactives sont consommées avec le temps. C'est une fonction nécessaire dans des applications comme les piles galvaniques (batteries), où la consommation de l'électrode génère le courant électrique.
Cela signifie que la durée de vie de l'appareil est directement liée à la quantité de matériau d'électrode réactive disponible. Le choix du matériau dicte la tension de la cellule et sa longévité.
Faire le bon choix pour votre objectif
Votre choix de matériau d'électrode doit être entièrement dicté par l'objectif de votre cellule électrochimique.
- Si votre objectif principal est l'électrolyse sans contamination : Vous avez besoin d'une électrode inerte. Utilisez du platine ou de l'or pour les travaux de laboratoire de haute pureté, ou du graphite (carbone) pour une alternative économique.
- Si votre objectif principal est de créer une cellule galvanique (une batterie) : Vous avez besoin de deux électrodes réactives différentes. Utilisez des matériaux comme le zinc et le cuivre, dont la différence de potentiel chimique entraîne le courant électrique.
- Si votre objectif principal est de plaquer un objet : Votre anode (électrode positive) doit être une électrode réactive faite du métal que vous souhaitez plaquer (par exemple, l'argent), et votre cathode (électrode négative) sera l'objet lui-même.
En fin de compte, la bonne électrode est celle dont les propriétés chimiques et physiques correspondent précisément à la fonction spécifique qu'elle doit remplir au sein de votre cellule électrochimique.
Tableau récapitulatif :
| Type d'électrode | Rôle dans la réaction | Matériaux courants | Applications clés |
|---|---|---|---|
| Électrode inerte | Facilitateur passif ; ne réagit pas | Platine, Or, Graphite | Électrolyse, Travaux de laboratoire de haute pureté |
| Électrode réactive | Participant actif ; est consommée ou formée | Cuivre, Zinc, Argent, Plomb | Piles, Électrodéposition |
Vous avez du mal à choisir le bon matériau d'électrode pour votre application ? La performance de votre processus électrochimique dépend de ce choix critique. KINTEK se spécialise dans la fourniture d'équipements de laboratoire et de consommables de haute qualité, y compris une large gamme de matériaux d'électrodes tels que le platine, le graphite et les métaux réactifs. Nos experts peuvent vous aider à adapter le matériau parfait à vos besoins spécifiques — que ce soit pour l'électrolyse, le développement de batteries ou l'électrodéposition — garantissant des résultats et une efficacité optimaux. Contactez-nous dès aujourd'hui pour discuter de votre projet et laissez KINTEK être votre partenaire de précision. Contactez-nous via notre formulaire de contact
Guide Visuel
Produits associés
- Électrode en feuille de platine pour applications de laboratoire et industrielles
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode électrochimique en graphite, tige et plaque de graphite
- Électrode auxiliaire en platine pour usage en laboratoire
- Électrode à disque d'or
Les gens demandent aussi
- Comment un électrode à feuille de platine doit-elle être utilisée pendant une expérience ? Assurez des résultats précis et reproductibles
- Quelle est la maintenance recommandée pour les électrodes utilisées avec une cellule électrolytique entièrement en PTFE ? Assurer la longévité et la précision des données
- Quelles sont les fonctions du platine et du SCE dans les tests de corrosion de revêtement ? Améliorer la précision des données dans les systèmes à 3 électrodes
- Pourquoi un électrode en carbone vitreux est-elle utilisée comme substrat ? La clé pour tester avec précision la stabilité du platine
- Comment l'échantillon de l'électrode de travail est-il rendu conducteur ? Utilisation de ruban de cuivre pour une analyse électrochimique fiable
- Quelle est la fonction d'une électrode en feuille de platine de haute pureté ? Maîtriser l'oxydation anodique des nanotubes de TiO2
- Comment installer une électrode en fil/tige de platine ? Assurer des mesures électrochimiques précises
- Pourquoi les électrodes en graphite de haute pureté et les creusets en graphite sont-ils utilisés dans les réacteurs à plasma thermique ? Stabilité ultime