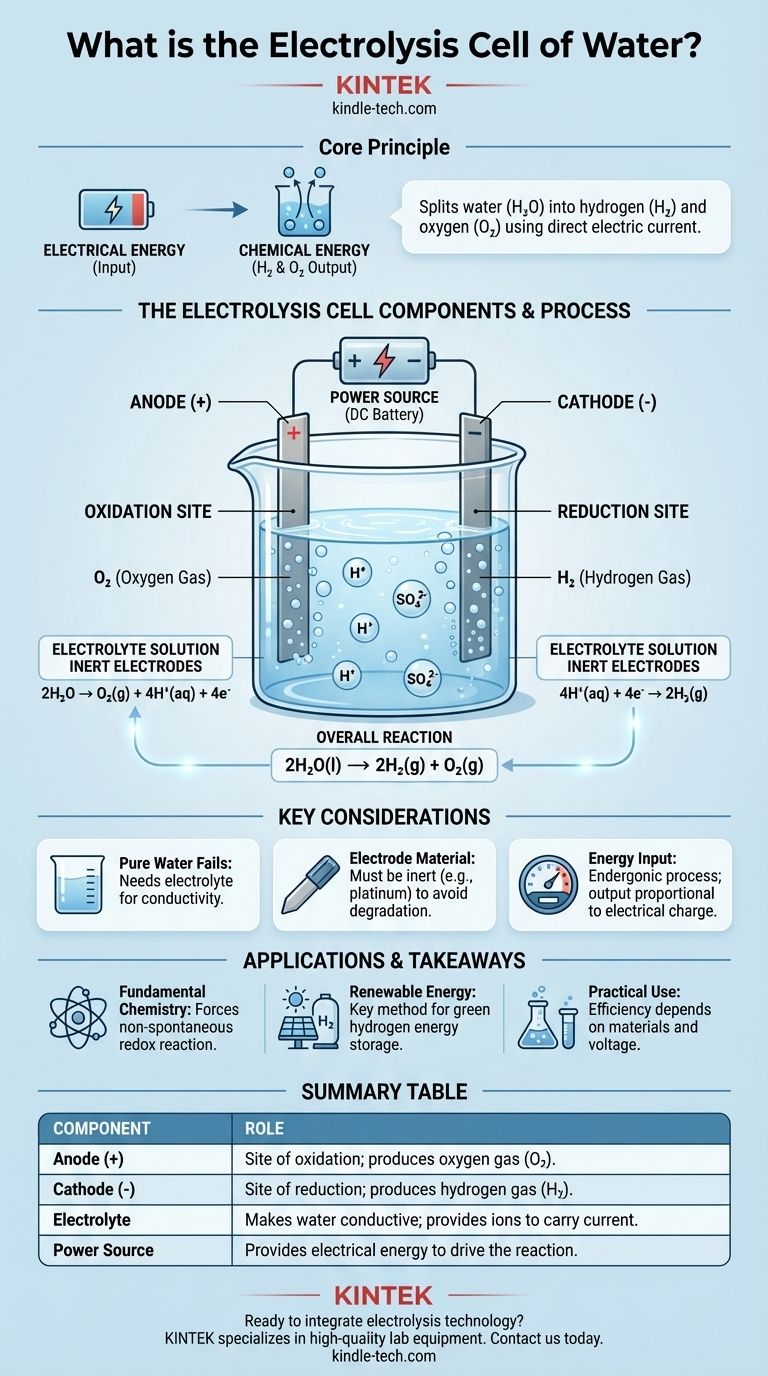
À la base, une cellule d'électrolyse de l'eau est un appareil qui utilise l'énergie électrique pour séparer l'eau (H₂O) en ses éléments constitutifs : le gaz hydrogène (H₂) et le gaz oxygène (O₂). Elle y parvient en faisant passer un courant électrique continu à travers de l'eau contenant une petite quantité d'un électrolyte, forçant ainsi un changement chimique qui ne se produirait pas spontanément. Les composants fondamentaux sont deux électrodes (une anode et une cathode) immergées dans l'électrolyte et connectées à une source d'alimentation externe.
L'objectif central d'une cellule d'électrolyse est de convertir l'énergie électrique en énergie chimique. Elle utilise une tension externe pour entraîner une réaction redox non spontanée, stockant efficacement l'énergie d'entrée dans les liaisons chimiques des molécules d'hydrogène et d'oxygène résultantes.

Les composants essentiels et leurs rôles
Une cellule électrolytique pour l'eau fonctionne grâce à l'interaction précise de trois éléments clés : les électrodes, l'électrolyte et la source d'alimentation. Chacun joue un rôle distinct et critique dans le processus.
Les électrodes : Anode et Cathode
La cellule contient deux électrodes, qui sont des conducteurs par lesquels l'électricité entre et sort de la solution. Celles-ci sont généralement fabriquées à partir d'un matériau inerte, comme le platine ou le graphite, pour s'assurer qu'elles facilitent la réaction sans être consommées par celle-ci.
L'anode est l'électrode positive. C'est le site de l'oxydation, où les substances perdent des électrons.
La cathode est l'électrode négative. C'est le site de la réduction, où les substances gagnent des électrons.
L'électrolyte : Rendre l'eau conductrice
L'eau pure est un très mauvais conducteur d'électricité car elle contient trop peu d'ions libres pour transporter efficacement un courant.
Pour résoudre ce problème, une petite quantité d'un électrolyte, tel que l'acide sulfurique (H₂SO₄), est ajoutée. L'électrolyte se dissout dans l'eau et fournit des ions mobiles (dans ce cas, H⁺ et SO₄²⁻) qui peuvent transporter la charge entre les électrodes, complétant ainsi le circuit électrique.
La source d'alimentation : Entraîner la réaction
La séparation de l'eau est une réaction endergonique, ce qui signifie qu'elle nécessite un apport d'énergie pour se produire. L'eau est stable et ne se décomposera pas spontanément.
Une source d'alimentation externe, comme une batterie ou une alimentation CC, fournit la tension nécessaire. Cette pression électrique "pousse" les électrons vers la cathode et les "tire" de l'anode, forçant la décomposition chimique de l'eau à se produire.
Le processus chimique : Comment l'eau est séparée
Le processus global est une réaction redox (réduction-oxydation), divisée en deux demi-réactions distinctes se produisant à chaque électrode.
Oxydation à l'anode (+)
À l'anode positive, les molécules d'eau sont oxydées. Elles cèdent leurs électrons, qui s'écoulent ensuite hors de la cellule vers le circuit externe.
Cette réaction produit du gaz oxygène (O₂) et des ions hydrogène (H⁺). La demi-réaction est : 2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
Réduction à la cathode (-)
Les ions hydrogène (H⁺) générés à l'anode (et présents dans l'électrolyte acide) sont attirés par la cathode négative.
À la cathode, ces ions gagnent des électrons provenant du circuit externe. Cette réaction de réduction produit du gaz hydrogène (H₂). La demi-réaction est : 4H⁺(aq) + 4e⁻ → 2H₂(g)
La réaction globale
Lorsque vous combinez les deux demi-réactions, les électrons et les ions hydrogène des deux côtés s'annulent, révélant le résultat simple et élégant de l'électrolyse de l'eau.
Le changement chimique net est : 2H₂O(l) → 2H₂(g) + O₂(g). Pour chaque deux molécules d'eau séparées, deux molécules de gaz hydrogène et une molécule de gaz oxygène sont produites.
Comprendre les considérations clés
Bien que le concept soit simple, plusieurs facteurs sont essentiels pour que la cellule fonctionne correctement et efficacement. Comprendre ces limitations révèle la vraie nature du processus.
Pourquoi l'eau pure échoue
Sans électrolyte, la résistance de l'eau est extrêmement élevée. L'application d'une tension entraînerait un courant négligeable, et donc, pratiquement aucune production d'hydrogène ou d'oxygène. L'électrolyte n'est pas consommé ; son seul rôle est d'agir comme porteur de charge.
Le matériau de l'électrode est crucial
L'utilisation d'électrodes inertes comme le platine est essentielle. Si vous utilisiez un métal réactif comme le zinc ou le cuivre pour l'anode, l'anode elle-même s'oxyderait et se dissoudrait dans la solution au lieu de l'eau. Cela produirait des produits différents et involontaires et détruirait l'électrode.
L'apport d'énergie dicte la production
L'électrolyse n'est pas une source d'énergie gratuite ; c'est un processus de conversion d'énergie. La quantité d'hydrogène et d'oxygène produite est directement proportionnelle à la quantité de charge électrique traversant la cellule. Il faut une quantité importante d'énergie électrique pour produire une petite quantité de gaz hydrogène.
Faire le bon choix pour votre objectif
Comprendre la cellule d'électrolyse est précieux pour plusieurs disciplines. Votre conclusion dépend de votre objectif sous-jacent.
- Si votre objectif principal est la chimie fondamentale : Voyez cela comme une démonstration parfaite de la façon dont l'énergie électrique peut forcer une réaction redox non spontanée, séparant un composé stable en ses éléments.
- Si votre objectif principal est l'énergie renouvelable : Reconnaissez l'électrolyse comme une méthode clé de stockage d'énergie, convertissant l'excès d'électricité provenant de sources comme le solaire ou l'éolien en carburant hydrogène.
- Si votre objectif principal est l'application pratique : N'oubliez pas que l'efficacité, le débit et les produits de l'électrolyse dépendent entièrement des matériaux spécifiques utilisés – l'électrolyte, le matériau de l'électrode et la tension appliquée.
En fin de compte, l'électrolyse de l'eau est un processus puissant qui utilise l'électricité pour libérer l'énergie chimique stockée dans une molécule simple.
Tableau récapitulatif :
| Composant | Rôle dans la cellule d'électrolyse |
|---|---|
| Anode (électrode positive) | Site d'oxydation ; produit du gaz oxygène (O₂). |
| Cathode (électrode négative) | Site de réduction ; produit du gaz hydrogène (H₂). |
| Électrolyte | Rend l'eau conductrice ; fournit des ions pour transporter le courant. |
| Source d'alimentation | Fournit l'énergie électrique pour entraîner la réaction non spontanée. |
Prêt à intégrer la technologie d'électrolyse dans les flux de travail de votre laboratoire ? KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité pour les processus chimiques avancés. Que vous développiez de nouvelles solutions de stockage d'énergie ou meniez des recherches fondamentales, notre expertise vous assure de disposer de l'équipement fiable dont vous avez besoin. Contactez notre équipe dès aujourd'hui pour discuter de la façon dont nous pouvons répondre à vos besoins spécifiques en laboratoire.
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique à cinq ports
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
Les gens demandent aussi
- Qu'est-ce qu'une cellule de type H ? Un guide des cellules électrochimiques divisées pour des expériences précises
- Quelle est la structure d'une cellule électrolytique à membrane échangeable de type H ? Un guide pour une séparation électrochimique précise
- Quel est le système expérimental typique utilisé avec une cellule électrolytique à double couche à bain-marie ? Obtenez un contrôle électrochimique précis
- Quelles sont les caractéristiques clés d'une cellule électrolytique à double enveloppe à bain-marie ? Obtenez un contrôle précis de la température pour vos expériences
- Comment doit-on stocker la cellule électrolytique de type H lorsqu'elle n'est pas utilisée ? Guide expert de stockage et de maintenance



















