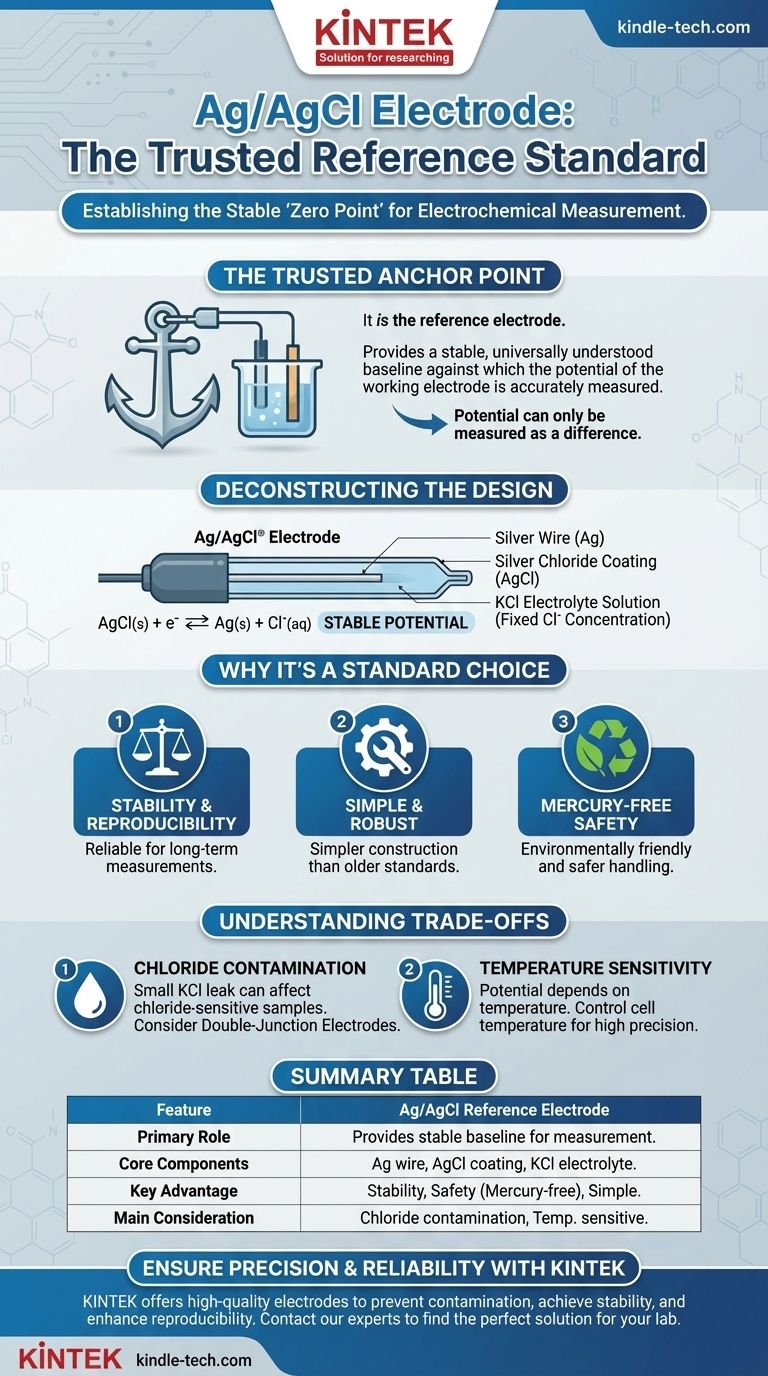
En bref, l'électrode Argent/Chlorure d'Argent (Ag/AgCl) n'est pas mesurée par rapport à une électrode de référence ; elle est l'électrode de référence. Elle fonctionne comme une demi-cellule standard stable et internationalement reconnue. Son but est de fournir une ligne de base de potentiel constante et fiable par rapport à laquelle le potentiel d'une autre électrode (l'« électrode de travail ») peut être mesuré avec précision.
Une électrode de référence est un outil nécessaire en électrochimie car le potentiel ne peut être mesuré que comme une différence entre deux points. L'électrode Ag/AgCl fournit un « point zéro » universellement compris et stable pour ces mesures, garantissant que les résultats sont cohérents et comparables entre différentes expériences.

Qu'est-ce qui fait qu'une électrode est une « référence » ?
Pour comprendre le rôle de l'électrode Ag/AgCl, il est essentiel de saisir pourquoi une référence est nécessaire en premier lieu. Vous ne pouvez pas mesurer le potentiel absolu d'une seule électrode ; vous ne pouvez mesurer que la différence de tension entre deux.
Le besoin d'une ligne de base stable
Dans toute mesure électrochimique, vous êtes intéressé par le potentiel changeant de votre électrode de travail lorsqu'elle interagit avec votre échantillon. Pour mesurer ce changement avec précision, vous avez besoin d'une seconde électrode qui a un potentiel constant et non fluctuant. Ce partenaire stable est l'électrode de référence.
Comment la stabilité est atteinte
La stabilité d'une électrode de référence provient d'un équilibre électrochimique soigneusement contrôlé. Il s'agit d'une réaction de demi-cellule dont les composants sont fixes, ce qui entraîne un potentiel qui ne change pas tant que les conditions comme la température et les concentrations des composants sont maintenues.
Déconstruction de l'électrode Ag/AgCl
L'électrode Ag/AgCl est une conception élégante et robuste qui atteint un potentiel très stable grâce à un équilibre chimique spécifique.
Composants principaux
L'électrode elle-même est remarquablement simple. Elle se compose d'un fil d'argent (Ag) de haute pureté qui a été recouvert d'une couche de chlorure d'argent (AgCl), un sel peu soluble dans l'eau.
L'électrolyte crucial
Ce fil revêtu est ensuite immergé dans une solution avec une concentration fixe d'ions chlorure (Cl⁻). Il s'agit presque toujours d'une solution de chlorure de potassium (KCl), généralement à une concentration élevée (par exemple, 3M ou saturée).
La réaction réversible
Le potentiel stable est généré par une réaction chimique réversible à la surface de l'électrode :
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Étant donné que l'argent et le chlorure d'argent sont solides, et que la concentration des ions chlorure dans la solution de remplissage est fixe, le potentiel de cette demi-réaction reste constant.
Pourquoi l'Ag/AgCl est un choix standard
L'électrode Ag/AgCl est devenue la référence la plus courante dans les laboratoires modernes pour plusieurs raisons pratiques.
Stabilité et reproductibilité
L'électrode fournit un potentiel très stable et reproductible sur de longues périodes, ce qui en fait une norme fiable pour les mesures de routine et de recherche.
Construction simple et robuste
Comparée aux anciennes normes comme l'électrode au calomel saturée (ECS), l'électrode Ag/AgCl est plus simple à fabriquer et moins fragile, ce qui a contribué à son adoption généralisée.
Sécurité et impact environnemental
Surtout, l'électrode Ag/AgCl est sans mercure. Cela la rend nettement plus sûre à manipuler et à éliminer que les électrodes à base de mercure, qui sont désormais soumises à des restrictions dans de nombreux laboratoires en raison de préoccupations environnementales et sanitaires.
Comprendre les compromis
Bien qu'elle soit la norme de l'industrie, aucune électrode de référence n'est parfaite pour toutes les situations. Il est important de connaître ses limites.
Contamination par le chlorure
L'électrode est conçue avec une fritte poreuse qui permet un contact électrique avec la solution échantillon. Au fil du temps, une petite quantité de la solution de remplissage de KCl peut s'échapper dans votre échantillon. Ceci est problématique si votre échantillon contient des espèces qui réagissent avec le chlorure, comme les ions argent.
Sensibilité à la température
Le potentiel de l'électrode Ag/AgCl dépend de la température. Pour un travail de haute précision, la température de la cellule doit être contrôlée et rapportée, ou une correction de température doit être appliquée aux données.
Faire le bon choix pour votre mesure
Votre choix d'électrode de référence dépend entièrement de la nature chimique de votre expérience et du niveau de précision que vous exigez.
- Si votre objectif principal est l'analyse générale en laboratoire : L'électrode Ag/AgCl est le choix par défaut pour son excellent équilibre entre stabilité, sécurité et coût.
- Si votre échantillon est sensible aux ions chlorure : Vous devez envisager une électrode Ag/AgCl à « double jonction » ou une alternative comme l'électrode Mercure/Sulfate mercureux (Hg/Hg₂SO₄), qui utilise une solution de remplissage sans chlorure.
- Si vous exigez la plus haute précision sur une gamme de températures : Vous devez contrôler activement la température de votre cellule électrochimique, quelle que soit la référence que vous utilisez.
En fin de compte, l'électrode Argent/Chlorure d'Argent sert de point d'ancrage fiable et stable, essentiel pour une analyse électrochimique précise et significative.
Tableau récapitulatif :
| Caractéristique | Électrode de référence Ag/AgCl |
|---|---|
| Rôle principal | Fournit une ligne de base de potentiel stable pour mesurer une électrode de travail. |
| Composants principaux | Fil d'argent recouvert d'AgCl, immergé dans une solution électrolytique de KCl. |
| Avantage clé | Excellente stabilité, sécurité (sans mercure) et construction simple. |
| Considération principale | Contamination potentielle par le chlorure ; potentiel sensible à la température. |
Assurez-vous que vos mesures électrochimiques sont précises et fiables. La bonne électrode de référence est essentielle pour le succès de votre laboratoire. KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris une gamme complète d'électrodes de référence adaptées à vos besoins expérimentaux spécifiques.
Nos experts peuvent vous aider à sélectionner l'électrode idéale pour :
- Prévenir la contamination des échantillons.
- Obtenir une stabilité de mesure supérieure.
- Améliorer la reproductibilité de vos résultats.
Contactez notre équipe dès aujourd'hui via notre formulaire sécurisé pour discuter de votre application et trouver la solution parfaite pour votre laboratoire.
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode électrochimique à disque métallique
- Électrode à disque d'or
- Électrode électrochimique en graphite, tige et plaque de graphite
Les gens demandent aussi
- Quelle est l'électrode de référence pour le sulfate de mercure/sulfate mercureux ? Un guide pour l'électrochimie sans chlorure
- Quelle électrode est utilisée comme référence ? Un guide pour des mesures électrochimiques précises
- Pourquoi une électrode à calomel saturée (ECS) est-elle utilisée comme électrode de référence dans la recherche sur les piles à combustible microbiennes ?
- Quelle est l'électrode de référence pour le mercure-chlorure de mercure ? Découvrez l'électrode au calomel saturé (ECS)
- Quel type d'électrode peut être utilisé comme point de référence ? Sélectionnez la bonne pour des mesures précises
















