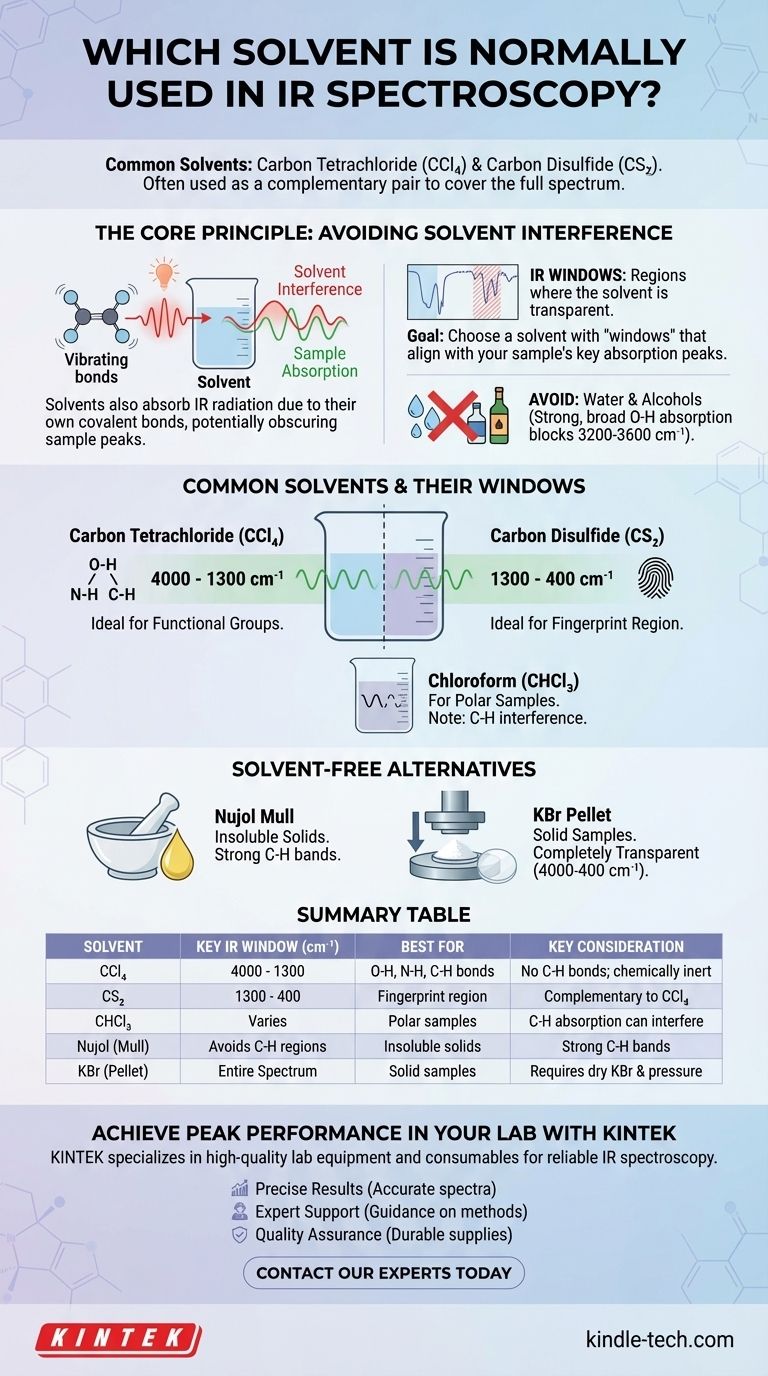
Les solvants les plus courants pour la spectroscopie IR sont le tétrachlorure de carbone (CCl₄) et le disulfure de carbone (CS₂). Parce qu'aucun solvant unique n'est transparent sur l'ensemble du spectre infrarouge, ces deux-là sont souvent utilisés comme une paire complémentaire pour analyser différentes régions. Le choix du solvant est crucial, car l'objectif est de dissoudre l'échantillon sans que les vibrations moléculaires propres au solvant n'obscurcissent les bandes d'absorption de l'échantillon.
Le principe fondamental de la sélection des solvants en spectroscopie IR est de trouver un milieu qui dissout votre composé mais qui est lui-même "invisible" dans la région spectrale qui vous intéresse. Puisqu'il n'existe pas de solvant parfait, le processus implique de choisir stratégiquement un solvant avec des "fenêtres IR" transparentes connues qui s'alignent avec les pics d'absorption clés de votre échantillon.

Le principe fondamental : éviter les interférences du solvant
La spectroscopie infrarouge fonctionne en mesurant les vibrations des liaisons moléculaires. Le défi est que les liaisons covalentes au sein de toute molécule de solvant absorberont également le rayonnement IR, créant leurs propres pics spectraux qui peuvent interférer avec ou masquer complètement les pics de votre échantillon.
Pourquoi les solvants absorbent le rayonnement IR
Tout comme votre échantillon, les molécules de solvant sont constituées d'atomes connectés par des liaisons covalentes. Ces liaisons (comme C-H, C-Cl, C=S) s'étirent et se plient à des fréquences spécifiques lorsqu'elles absorbent la lumière infrarouge. Cette absorption est la source d'interférence.
Le concept de "fenêtres IR"
Aucun solvant n'est transparent sur l'ensemble de la gamme IR moyenne (4000 – 400 cm⁻¹). Cependant, chaque solvant a des régions où il n'absorbe que faiblement ou pas du tout. Ces zones sont appelées "fenêtres IR".
L'objectif est de choisir un solvant dont les fenêtres correspondent aux régions d'absorption des groupes fonctionnels que vous souhaitez étudier dans votre échantillon.
Le problème de l'eau et des alcools
Les solvants contenant des groupes -OH, tels que l'eau et l'éthanol, ne sont presque jamais utilisés pour l'IR. La liaison O-H produit une bande d'absorption intensément forte et large qui obscurcit complètement une vaste et importante région du spectre (environ 3200-3600 cm⁻¹), rendant impossible de voir les pics de l'échantillon dans cette zone.
Solvants courants et leurs fenêtres
Pour obtenir un spectre complet, les chimistes effectuent souvent deux balayages du même échantillon : un dans un solvant transparent dans la région des hautes fréquences, et un autre dans un solvant transparent dans la région des basses fréquences "empreinte digitale".
Tétrachlorure de carbone (CCl₄)
C'est le choix standard pour la région de 4000 cm⁻¹ à 1300 cm⁻¹. Parce qu'il n'a pas de liaisons C-H, il est transparent là où les vibrations d'étirement C-H, N-H et O-H se produisent, ce qui le rend idéal pour analyser ces groupes fonctionnels critiques.
Disulfure de carbone (CS₂)
C'est le solvant complémentaire du CCl₄. Il est largement transparent dans la région d'empreinte digitale de 1300 cm⁻¹ à 400 cm⁻¹. Cela permet une analyse détaillée des vibrations complexes qui confèrent à une molécule son identité spectrale unique.
Chloroforme (CHCl₃)
Le chloroforme est un solvant plus polaire et peut être un bon choix si votre échantillon ne se dissout pas dans le CCl₄ ou le CS₂. Cependant, sa propre liaison C-H crée des bandes d'absorption (autour de 3000 cm⁻¹ et 1200 cm⁻¹) qui peuvent interférer avec l'analyse des liaisons C-H dans l'échantillon.
Comprendre les compromis et les alternatives
Le choix d'un solvant n'est qu'une façon de préparer un échantillon. Si votre composé est insoluble ou si l'interférence du solvant est inévitable, d'autres techniques standard existent.
L'inertie chimique est non négociable
Comme le note le document de référence, le solvant ne doit pas réagir avec votre échantillon. L'utilisation d'un solvant acide pour un échantillon basique, par exemple, entraînerait la formation d'une paire d'ions, et vous analyseriez le spectre d'une espèce chimique complètement différente de celle que vous aviez prévue.
Le Nujol Mull : une alternative sans solvant
Lorsqu'un échantillon est insoluble dans tous les solvants IR appropriés, un mull de Nujol est la technique préférée. L'échantillon solide est broyé en une poudre fine et mélangé avec une goutte de Nujol (une huile minérale) pour former une pâte.
Cette pâte est ensuite pressée entre deux plaques de sel pour l'analyse. Le Nujol lui-même est constitué d'hydrocarbures à longue chaîne, il montrera donc de fortes bandes d'absorption C-H, mais il est transparent ailleurs, permettant l'analyse de la plupart des autres groupes fonctionnels.
La pastille de KBr
Une autre méthode courante sans solvant est la pastille de KBr. L'échantillon solide est mélangé avec de la poudre de bromure de potassium (KBr) pure et sèche et pressé sous haute pression pour former un petit disque transparent. Le KBr est lié ioniquement et n'absorbe pas le rayonnement IR, ce qui en fait un milieu complètement transparent pour l'analyse.
Faire le bon choix pour votre analyse
Votre choix de méthode de préparation d'échantillon dépend entièrement des propriétés physiques de votre échantillon et des informations spécifiques dont vous avez besoin du spectre.
- Si votre objectif principal concerne les liaisons O-H, N-H ou C-H (4000-1300 cm⁻¹) : Utilisez le tétrachlorure de carbone (CCl₄) pour son excellente transparence dans cette région.
- Si votre objectif principal concerne la région d'empreinte digitale (1300-400 cm⁻¹) : Utilisez le disulfure de carbone (CS₂) pour obtenir une vue claire des vibrations complexes uniques à votre molécule.
- Si votre échantillon est insoluble dans les solvants non polaires : Envisagez une option plus polaire comme le chloroforme, ou contournez complètement les solvants liquides et préparez une pastille de KBr ou un mull de Nujol.
En fin de compte, une préparation d'échantillon efficace consiste à s'assurer que le spectre que vous enregistrez est celui de votre composé, et non un artefact de votre milieu choisi.
Tableau récapitulatif :
| Solvant | Fenêtre IR clé (cm⁻¹) | Idéal pour | Considération clé |
|---|---|---|---|
| Tétrachlorure de carbone (CCl₄) | 4000 - 1300 | Liaisons O-H, N-H, C-H | Pas de liaisons C-H ; chimiquement inerte |
| Disulfure de carbone (CS₂) | 1300 - 400 | Région d'empreinte digitale | Complémentaire au CCl₄ |
| Chloroforme (CHCl₃) | Varie (par exemple, des lacunes autour de 3000 cm⁻¹) | Échantillons polaires | L'absorption C-H peut interférer |
| Nujol (Mull) | Évite les régions C-H | Solides insolubles | Fortes bandes C-H du Nujol |
| KBr (Pastille) | Spectre entier (4000-400) | Échantillons solides | Nécessite du KBr sec et une haute pression |
Atteignez des performances optimales dans votre laboratoire
La navigation dans la sélection des solvants n'est qu'une étape vers une analyse précise des matériaux. KINTEK est spécialisé dans la fourniture d'équipements et de consommables de laboratoire de haute qualité dont vous avez besoin pour une spectroscopie IR fiable et au-delà.
Laissez-nous vous aider à améliorer les capacités de votre laboratoire :
- Résultats précis : Assurez-vous que votre préparation d'échantillons conduit à des spectres précis et sans interférence.
- Soutien d'experts : Obtenez des conseils sur les bons outils et méthodes pour votre application spécifique.
- Assurance qualité : Faites confiance à nos fournitures durables et fiables pour des performances constantes.
Prêt à optimiser vos processus analytiques ? Contactez nos experts dès aujourd'hui pour discuter de la manière dont KINTEK peut soutenir les besoins uniques de votre laboratoire en spectroscopie et en analyse des matériaux.
Guide Visuel
Produits associés
- Creuset d'évaporation pour matière organique
- Dioxyde d'iridium IrO2 pour l'électrolyse de l'eau
- Réacteur Autoclave de Laboratoire Haute Pression pour Synthèse Hydrothermale
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
Les gens demandent aussi
- Comment un agitateur orbital de paillasse facilite-t-il la production de sucres réducteurs ? Augmenter les rendements de l'hydrolyse de la cellulose
- Quels sont les types de température de pyrolyse ? Un guide sur la pyrolyse à basse, moyenne et haute température
- Quelle est la différence entre la pyrolyse conventionnelle et la pyrolyse par micro-ondes ? Débloquez un chauffage plus rapide et plus efficace
- Pourquoi un homogénéisateur ultrasonique industriel est-il utilisé lors du traitement des bioproduits ? Maîtrisez l'extraction des PHA et la viscosité des fluides
- À quelle température le verre de quartz fond-il ? Comprendre son point de ramollissement et ses limites pratiques
- Quel est le but du traitement thermique ? Libérez tout le potentiel de votre matériau
- Quels sont les avantages du forgeage par presse par rapport au forgeage par estampage ? Obtenez une intégrité interne supérieure pour les composants critiques
- Quelle est la différence entre la pulvérisation DC et la pulvérisation magnétron DC ? Débloquez des taux de dépôt plus élevés





