Introduction à l'électrode de Glymercure
Définition et composition
L'électrode de glycure est un dispositif spécialisé constitué d'une solution de mercure métallique et de ses sels insolubles, Hg₂Cl₂ (calomel) et KCl (chlorure de potassium).La composition de cette électrode est cruciale car elle influence directement ses caractéristiques opérationnelles.Le potentiel de l'électrode au glymercure est très sensible à la concentration d'ions chlorure, une propriété largement utilisée en chimie analytique.Cette sensibilité est quantifiée et tabulée, ce qui permet d'effectuer des mesures précises dans diverses configurations expérimentales.
L'une des caractéristiques notables de l'électrode de glycure est son coefficient de température minimal du potentiel électrique.Cette caractéristique est particulièrement avantageuse lorsque l'électrode est immergée dans une solution de chlorure de potassium d'une concentration de 0,1 mol-dm³.Dans ces conditions, la variation du potentiel électrique en fonction des changements de température est négligeable, ce qui garantit des mesures stables et fiables.Cette stabilité est l'une des principales raisons pour lesquelles l'électrode de glycure est préférée dans de nombreuses applications analytiques, en particulier lorsque des lectures précises et cohérentes sont essentielles.
Préparation et utilisation comme pont salin
L'électrode de glycure, lorsqu'elle est saturée de chlorure de potassium, offre un processus de préparation simple et sert de pont salin efficace pendant son fonctionnement.Cette facilité de préparation et cette fonctionnalité en font un choix privilégié dans diverses applications de chimie analytique.
Pour préparer l'électrode au glymercure en tant que pont salin, une solution de mercure métallique est combinée avec ses sels insolubles, à savoir Hg₂Cl₂ et KCl.La concentration d'ions chlorure dans la solution influence directement le potentiel de l'électrode, qui est un facteur critique de sa performance.Notamment, le coefficient de température du potentiel électrique reste faible, en particulier lorsque la solution de chlorure de potassium est maintenue à une concentration de 0,1 mol-dm.
Dans la pratique, l'électrode de glycure agit comme un conduit, facilitant le mouvement des ions entre deux solutions sans permettre un mélange direct.Cette capacité est cruciale pour maintenir l'intégrité de l'environnement chimique dans chaque solution, garantissant ainsi des mesures précises et fiables dans les méthodes potentiométriques.
Le rôle de l'électrode de glycure en tant que pont salin est encore renforcé par sa compatibilité avec d'autres électrodes, telles que l'électrode de calomel, qui sert de référence stable.Cette association permet une détermination précise des potentiels d'électrode, consolidant le statut de l'électrode de glycure en tant qu'électrode standard secondaire.

Informations de base
Nom chinois
L'électrode au glymercure, connue en chinois sous le nom de 甘汞电极 (Gān gǒng diàn jí), est un outil spécialisé en chimie analytique.Cette électrode est composée de mercure métallique, de ses sels insolubles Hg₂Cl₂ et d'une solution de chlorure de potassium (KCl).Le potentiel de l'électrode est sensible à la concentration d'ions chlorure, ce qui en fait un composant précieux dans diverses procédures analytiques.En particulier, le coefficient de température de son potentiel électrique est minime, surtout lorsqu'elle est utilisée avec une solution de chlorure de potassium de 0,1 mol-dm, ce qui garantit la stabilité et la reproductibilité des mesures.
Dans le contexte de la nomenclature scientifique chinoise, le terme 甘汞 (Gān gǒng) se traduit directement par "mercure doux" ou "glycymercure", reflétant la composition primaire de l'électrode.Cette convention de dénomination souligne les propriétés uniques de l'électrode et son rôle en chimie analytique, où elle sert à la fois d'indicateur et d'électrode de référence dans les méthodes potentiométriques.Son nom chinois indique non seulement sa composition chimique, mais souligne également son importance sur le terrain, où elle est souvent préférée pour sa facilité de préparation et son utilisation en tant que pont salin.
Température applicable
L'électrode de glycure est conçue pour fonctionner de manière optimale dans une plage de température spécifique, à savoir en dessous de 70°C .L'utilisation de l'électrode au-delà de ce seuil peut entraîner une instabilité de sa valeur potentielle, ce qui la rend moins fiable pour des mesures précises en chimie analytique.Cette limitation de température est cruciale pour maintenir les performances et la longévité de l'électrode, en veillant à ce qu'elle reste une option viable pour diverses applications.
Pour comprendre pourquoi cette contrainte de température existe, il est important d'examiner les composants de l'électrode de glycure, en particulier les éléments suivants Hg₂Cl₂ (calomel) et KCl (chlorure de potassium) (chlorure de potassium).Au-delà de 70°C, l'activité thermique peut perturber l'équilibre de ces solutions, entraînant des fluctuations du potentiel de l'électrode.Cette instabilité peut compromettre la précision des mesures, en particulier dans les procédures analytiques sensibles.
| Plage de température | Stabilité de l'électrode |
|---|---|
| Inférieure à 70°C | Stable et fiable |
| Au-dessus de 70°C | Instabilité et manque de fiabilité |
Il est essentiel de maintenir l'électrode dans la plage de température recommandée pour préserver son intégrité et garantir des résultats cohérents.Cette précaution permet de s'assurer que l'électrode de glycure reste un outil fiable en chimie analytique, en particulier dans les applications nécessitant des mesures précises et reproductibles.
Potentiel de l'électrode
L'électrode de glycure présente un potentiel d'électrode stable et bien documenté, ce qui est crucial pour son utilisation en chimie analytique.Plus précisément, cette électrode conserve un potentiel de +0,2415 V dans des conditions standard, ce qui en fait une référence fiable pour diverses mesures électrochimiques.
Cette valeur de potentiel spécifique est particulièrement significative lorsque l'électrode est utilisée en conjonction avec l'électrode à hydrogène standard (SHE).En comparant le potentiel de l'électrode au glymercure à celui de l'électrode à hydrogène standard, les chercheurs peuvent déterminer avec précision le potentiel relatif de l'électrode d'autres systèmes.Ce processus est essentiel pour l'étalonnage et la normalisation des mesures électrochimiques, garantissant la précision et la reproductibilité des résultats expérimentaux.
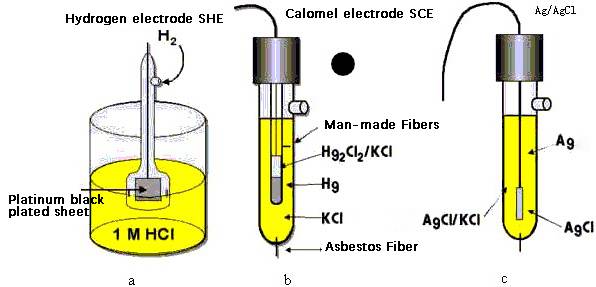
En outre, le potentiel de l'électrode de glycure est connu pour être relativement insensible aux changements de température, en particulier lorsqu'elle est immergée dans une solution de chlorure de potassium de 0,1 mol-dm.Cette caractéristique renforce encore son utilité en tant qu'électrode de référence, car elle minimise les fluctuations de potentiel dues aux variations environnementales.
En résumé, le potentiel stable de +0,2415V de l'électrode de glycure, associé à son faible coefficient de température, en fait un outil précieux dans le domaine de la chimie analytique, en particulier pour les mesures potentiométriques et en tant qu'électrode étalon secondaire.
Caractéristiques
L'une des caractéristiques principales de l'électrode de glycure est son petit coefficient de température du potentiel électrique .Cette caractéristique est particulièrement avantageuse en chimie analytique, où la précision et la stabilité sont primordiales.Le coefficient de température correspond à la variation du potentiel de l'électrode en fonction des variations de température.Pour l'électrode de glycure, ce coefficient reste minime, en particulier lorsque l'électrode est immergée dans une solution de chlorure de potassium d'une concentration de 0,1 mol-dm.Cette stabilité garantit que le potentiel de l'électrode reste relativement constant même dans des conditions de température fluctuantes, ce qui la rend très fiable pour une utilisation dans diverses procédures analytiques.
Le faible coefficient de température résulte directement de la composition de l'électrode, qui comprend du mercure métallique, du Hg₂Cl₂ et une solution de KCl.L'interaction entre ces composants permet de maintenir un potentiel stable, ce qui est essentiel pour obtenir des mesures précises dans les méthodes potentiométriques.Cette caractéristique améliore non seulement la reproductibilité de l'électrode, mais étend également son applicabilité à différents dispositifs expérimentaux, où le contrôle de la température peut ne pas être parfaitement assuré.
En résumé, le faible coefficient de température du potentiel électrique de l'électrode de glycure est une caractéristique clé qui souligne son aptitude à être utilisée comme électrode de référence en chimie analytique, où la cohérence et la fiabilité sont essentielles.
Composants
L'électrode au mercure est composée de trois éléments principaux : le mercure métallique (Hg), le chlorure mercureux (Hg₂Cl₂) et une solution de chlorure de potassium (KCl).Chacun de ces composants joue un rôle crucial dans le fonctionnement et la stabilité de l'électrode.
-
Mercure métallique (Hg) : Il forme le cœur de l'électrode et est essentiel pour établir l'interface électrochimique.Sa densité élevée et son faible point de fusion lui permettent de maintenir un potentiel d'électrode stable.
-
Chlorure mercureux (Hg₂Cl₂) : Également connu sous le nom de calomel, ce composé est insoluble dans l'eau et agit comme un tampon pour stabiliser le potentiel de l'électrode.Il permet à l'électrode de conserver une réponse cohérente aux variations de la concentration en ions chlorure.
-
Solution de chlorure de potassium (KCl) : Cette solution a plusieurs fonctions.Tout d'abord, elle fournit les ions chlorure nécessaires pour interagir avec le chlorure mercureux.Deuxièmement, il contribue à la préparation de l'électrode en facilitant la dissolution d'autres composants.La concentration de KCl varie généralement de 0,1 mol-dm à des solutions saturées, ces dernières étant plus couramment utilisées en raison de leur facilité de préparation et de leur stabilité.
La combinaison de ces composants permet d'obtenir une électrode dont le coefficient de température du potentiel électrique est faible, ce qui la rend très fiable pour une utilisation en chimie analytique, en particulier dans les méthodes potentiométriques.

Domaines d'application
L'électrode de glycure trouve sa principale application dans le domaine de la chimie analytique .Cette électrode spécialisée sert d'outil pivot dans diverses techniques d'analyse, en particulier dans les cas suivants les méthodes potentiométriques .Dans ces méthodes, l'électrode de glycure sert souvent d'électrode indicatrice. électrode indicatrice électrode indicatrice, dont le potentiel varie en fonction des changements de concentration d'ions spécifiques dans la solution analysée.
L'un des principaux avantages de l'électrode de glycure en chimie analytique est sa sa stabilité et sa reproductibilité .Ces qualités en font un candidat idéal pour une utilisation en conjonction avec une électrode de référence comme l'électrode de calomel.Ensemble, ils forment une cellule électrochimique fiable, permettant des mesures précises du potentiel des électrodes.Cette configuration est cruciale pour des applications allant de la mesure du pH à la détermination de diverses concentrations d'ions.
En outre, la capacité de l'électrode au glymercure à agir en tant qu'électrode standard secondaire est un atout majeur. électrode standard secondaire souligne encore son importance en chimie analytique.En l'associant à l'électrode standard à hydrogène, les chercheurs peuvent calibrer et déterminer avec précision le potentiel d'électrode de l'électrode de glycure, ce qui garantit la précision et la fiabilité de leurs mesures analytiques.
En résumé, le rôle de l'électrode de glycure en chimie analytique est multiple, englobant son utilisation en tant qu'électrode indicatrice, sa stabilité dans les mesures potentiométriques et ses capacités d'étalonnage en tant qu'électrode standard secondaire.Ces applications soulignent son caractère indispensable dans le domaine de la chimie analytique.
Contenu de base en chimie analytique
Électrodes indicatrices et de référence
Dans les méthodes potentiométriques, l'électrode au mercure sert d'électrode indicatrice, tandis que l'électrode au calomel sert d'électrode de référence stable.L'électrode au calomel est constituée de mercure métallique, de calomel (Hg₂Cl₂) et de chlorure de potassium (KCl).Cette configuration garantit que l'électrode de calomel maintient un potentiel d'électrode stable et bien connu, ce qui est crucial pour des mesures potentiométriques précises.
Pour obtenir cette stabilité, l'électrode de calomel utilise un système redox avec des concentrations constantes de ses composants, créant ainsi un système tamponné.Cette caractéristique fait de l'électrode de calomel une électrode de référence (ER) idéale dans l'analyse potentiométrique.Contrairement à l'électrode indicatrice, qui réagit de manière variable aux variations de l'analyte, l'électrode de référence reste stable avec une réponse fixe, fournissant ainsi une base de référence fiable pour les mesures de potentiel.
La distinction entre les électrodes indicatrices et de référence est fondamentale dans les titrages potentiométriques.Les électrodes indicatrices, telles que l'électrode de glycure, modifient leur potentiel en réponse à l'analyte, reflétant ainsi la concentration de la substance mesurée.En revanche, les électrodes de référence, comme l'électrode de calomel, maintiennent un potentiel constant, garantissant que tout changement de potentiel observé est dû à l'analyte et non au système de mesure lui-même.
Il existe différents types d'électrodes indicatrices, notamment des électrodes à membrane de verre, à membrane de cristal et à membrane de polymère, chacune étant adaptée à des besoins analytiques différents.Cependant, l'électrode de calomel reste un élément essentiel dans les applications d'électrodes de référence en raison de sa fiabilité et de la simplicité avec laquelle elle maintient un potentiel stable.
Électrode standard à hydrogène
L'électrode standard à hydrogène (SHE) est une référence essentielle en électrochimie, car elle fournit une base normalisée pour déterminer les valeurs relatives du potentiel électrique d'autres électrodes.Malgré sa stabilité, l'électrode SHE est connue pour la complexité de son fonctionnement, ce qui la rend souvent moins pratique pour une utilisation de routine en laboratoire.
Le SHE fonctionne dans des conditions standard, avec de l'hydrogène gazeux à une pression de 1 atmosphère et une concentration d'ions hydrogène de 1 M en solution.Cette configuration garantit que le potentiel de l'électrode reste constant et fiable.Cependant, la nécessité d'un approvisionnement constant en hydrogène gazeux et l'entretien méticuleux requis pour maintenir ces conditions rendent la SHE encombrante et peu pratique pour de nombreuses applications.
En revanche, d'autres électrodes de référence, telles que l'électrode au calomel, offrent une alternative plus conviviale.Ces électrodes, bien qu'elles ne soient pas aussi universellement applicables que la SHE, fournissent un potentiel de référence stable et reproductible qui est essentiel pour des mesures précises en chimie analytique.
Le rôle principal de la SHE est d'établir un point de référence de potentiel zéro, par rapport auquel les potentiels des autres électrodes peuvent être mesurés.Cette normalisation est cruciale pour l'interprétation précise des données électrochimiques et est fondamentale dans le domaine de l'électrochimie.Malgré ses limites, la SHE reste un outil indispensable pour l'étalonnage et la validation des instruments électrochimiques.
Électrode standard secondaire
L'électrode de glycure, lorsqu'elle est couplée à l'électrode d'hydrogène standard, sert d'outil fiable pour déterminer son potentiel d'électrode, ce qui lui vaut la désignation d'électrode étalon secondaire.Ce couplage permet des mesures précises, qui sont cruciales en chimie analytique où la précision est primordiale.
L'électrode standard à hydrogène (SHE) est généralement utilisée comme référence pour établir la valeur relative du potentiel électrique d'autres électrodes.Cependant, l'électrode SHE est connue pour sa stabilité, mais elle est difficile à utiliser en raison de sa complexité et de la nécessité d'une alimentation continue en hydrogène gazeux.En revanche, l'électrode de glycure offre une alternative plus pratique.
Utilisée conjointement avec l'électrode SHE, l'électrode au glymercure peut déterminer avec précision son potentiel, ce qui en fait un étalon secondaire.Cette capacité est particulièrement précieuse en chimie analytique, où la reproductibilité et la stabilité sont essentielles pour obtenir des résultats fiables.Le potentiel de l'électrode au glymercure est influencé par la concentration en ions chlorure, qui peut être contrôlée et mesurée avec précision, ce qui contribue à son exactitude.
Ce rôle d'étalon secondaire de l'électrode de glycure souligne son importance dans les méthodes potentiométriques, où elle joue souvent le rôle d'électrode indicatrice.Sa capacité à fournir des mesures de potentiel précises simplifie le processus d'étalonnage des autres électrodes, améliorant ainsi la précision globale des mesures analytiques.
Utilisations et applications
Électrode de référence en potentiométrie
L'électrode de glycure est fréquemment utilisée comme électrode de référence en potentiométrie, en raison de sa reproductibilité et de sa stabilité exceptionnelles.Dans les mesures potentiométriques, le rôle d'une électrode de référence est primordial, car elle sert de point constant et fiable par rapport auquel le potentiel des autres électrodes est mesuré.Cette stabilité est essentielle pour obtenir des mesures précises, car toute fluctuation du potentiel de l'électrode de référence peut entraîner des résultats erronés.
Pour garantir cette stabilité, les électrodes de référence sont conçues pour maintenir un potentiel constant, idéalement sur une échelle absolue.Cela est possible grâce à deux caractéristiques clés : un flux de courant minimal et une électrode "bien positionnée".Une électrode bien polarisée conserve son potentiel même lorsqu'elle est soumise à des flux de courant mineurs, ce qui garantit que sa valeur de référence n'est pas affectée.
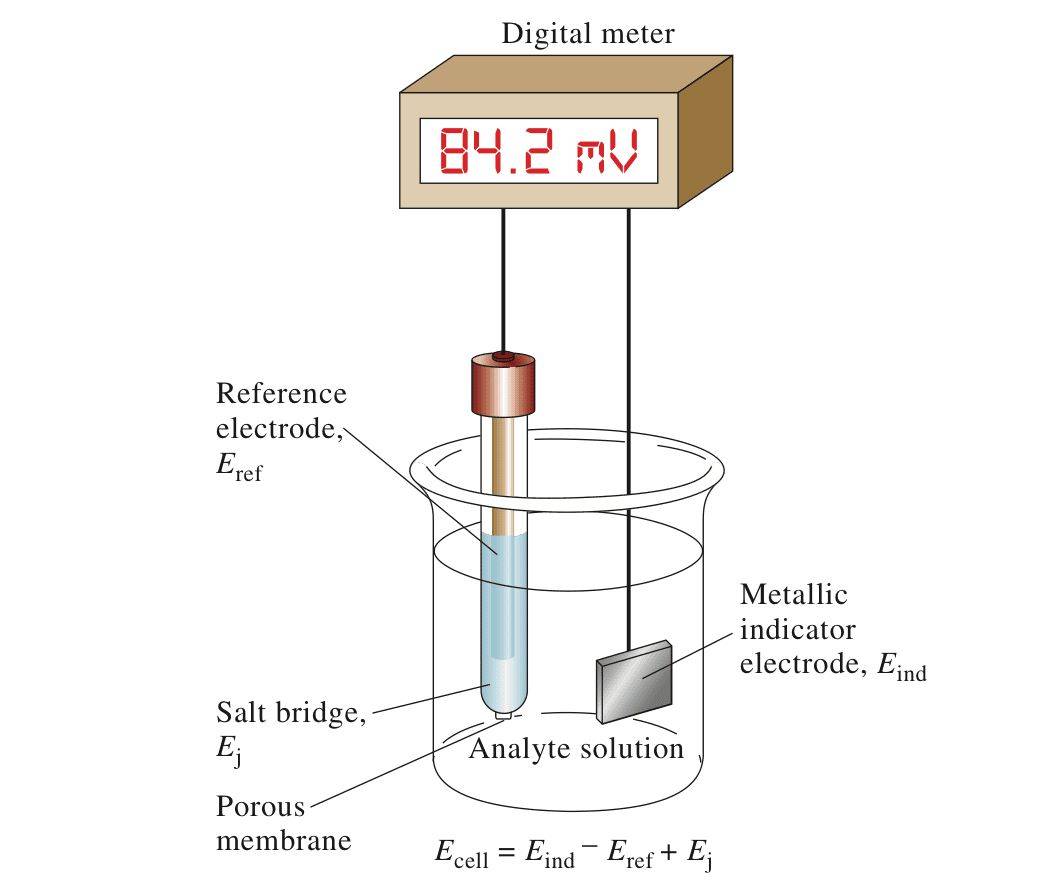
Bien qu'il existe plusieurs types d'électrodes de référence, les plus couramment utilisées et disponibles dans le commerce sont les électrodes argent/chlorure d'argent, calomel saturé, oxyde de mercure/mercure, sulfate de mercure/mercure et sulfate de cuivre/cuivre.Ces électrodes sont appréciées pour leur fiabilité et leur facilité d'utilisation dans diverses applications analytiques.
Dans les titrages potentiométriques, la distinction entre les électrodes indicatrices et les électrodes de référence est essentielle.L'électrode indicatrice réagit aux changements de l'analyte, reflétant les variations de concentration, tandis que l'électrode de référence reste stable, fournissant un potentiel fixe.Cette double configuration garantit que les mesures de potentiel sont à la fois précises et reproductibles, ce qui fait de l'électrode de glycure un choix idéal pour ces applications.
Réaction de l'électrode et symboles
La réaction de l'électrode au mercure est un processus fondamental qui implique la réduction du chlorure mercureux (Hg₂Cl₂) en mercure élémentaire (Hg) et en ions chlorure (Cl-).Cette réaction peut être représentée comme suit :
Hg₂Cl₂ + 2e⁻ → 2Hg + 2Cl⁻
Ce processus électrochimique est crucial pour la fonction de référence de l'électrode en chimie analytique.Les symboles utilisés pour décrire l'électrode de glycure dans une notation standard sont les suivants :
Pt | Hg(l) | Hg₂Cl₂(s) | KCl(saturated)
Ici, les symboles désignent :
- Pt:Le fil de platine inerte qui sert de collecteur de courant.
- Hg(l):Le mercure liquide, qui est le métal actif de l'électrode.
- Hg₂Cl₂(s):Le chlorure mercureux solide, qui est en équilibre avec le mercure.
- KCl(saturé):La solution saturée de chlorure de potassium, qui fournit les ions chlorure nécessaires à la réaction de l'électrode.
Cette notation est essentielle pour représenter avec précision la composition de l'électrode et les conditions dans lesquelles elle fonctionne, assurant ainsi la cohérence et la reproductibilité des montages expérimentaux.
Limites de température
L'électrode de calomel, bien que très fiable à des températures de laboratoire standard, présente une instabilité notable lorsqu'elle est soumise à une chaleur élevée.Plus précisément, sa valeur potentielle devient erratique au-dessus de 70°C, ce qui la rend impropre à des mesures précises dans de telles conditions.En outre, une exposition prolongée à des températures supérieures à 100°C peut réduire considérablement la durée de vie de l'électrode.Par conséquent, il est impératif de limiter l'utilisation de l'électrode de calomel à des températures inférieures à 70°C pour garantir à la fois la précision et la longévité.
Dans les applications pratiques, cette limitation nécessite une attention particulière lors de la sélection de l'électrode appropriée pour les différentes configurations expérimentales.Par exemple, en chimie analytique à haute température, des électrodes de référence alternatives avec des tolérances de température plus larges peuvent être préférées.Cela permet de garantir que l'intégrité des données recueillies n'est pas compromise par les contraintes de température inhérentes à l'électrode de calomel.
Types d'électrodes
Classification des électrodes
Les électrodes peuvent être classées en plusieurs catégories en fonction de leur composition et de la nature des réactions électrochimiques qu'elles facilitent.Ces catégories comprennent les électrodes à ions métal-métal, les électrodes à ions gaz, les électrodes à sels insolubles métal-métal et les électrodes d'oxydoréduction.Chaque type présente des caractéristiques et des applications distinctes en électrochimie.
-
Électrodes ioniques métal-métal:Ces électrodes sont constituées d'un métal immergé dans une solution contenant ses propres ions.Le potentiel de ces électrodes est déterminé par la concentration d'ions métalliques dans la solution.
-
Électrodes gaz-ion:Ces électrodes mettent en jeu un gaz (tel que l'hydrogène ou le chlore) en équilibre avec ses ions en solution.Un exemple typique est l'électrode standard à hydrogène (SHE), utilisée comme électrode de référence universelle.
-
Électrodes métal-métal à sel insoluble:Cette catégorie comprend les électrodes où un métal est en contact avec un sel insoluble du métal et une solution contenant l'anion du sel.L'électrode au glymercure, qui se compose de mercure métallique en contact avec son sel insoluble Hg₂Cl₂ et une solution de chlorure de potassium, entre dans cette catégorie.Le potentiel d'électrode de l'électrode au glymercure est influencé par la concentration d'ions chlorure et est connu pour sa stabilité et sa reproductibilité, ce qui en fait un choix populaire en tant qu'électrode de référence en potentiométrie.
-
Électrodes d'oxydoréduction:Ces électrodes impliquent un couple d'oxydoréduction en solution, où la réaction d'oxydoréduction se produit sur un matériau d'électrode inerte comme le platine.Le potentiel d'une électrode redox est déterminé par le rapport entre les espèces oxydées et réduites dans la solution.
L'électrode de glycure, avec sa composition unique et son potentiel stable, est particulièrement importante en chimie analytique, où elle sert d'électrode de référence fiable.Sa classification en tant qu'électrode à sel insoluble métal-métal souligne son rôle spécialisé dans les mesures électrochimiques et sa compatibilité avec diverses techniques analytiques.

Autres électrodes typiques
Dans le domaine des électrodes à sels insolubles métal-métal, l'électrode de chlorure d'argent-argent se distingue comme un pendant notable de l'électrode de glymercure.Cette électrode est largement utilisée dans diverses applications de chimie analytique en raison de sa stabilité et de sa reproductibilité.
Composition et fonctionnement
L'électrode argent-chlorure d'argent est constituée d'un fil d'argent recouvert d'une fine couche de chlorure d'argent (AgCl), immergé dans une solution de chlorure de potassium (KCl).Cette configuration garantit un potentiel d'électrode stable, ce qui en fait un excellent choix pour les électrodes de référence dans les mesures potentiométriques.
| Composant | Rôle |
|---|---|
| Fil d'argent | Fournit la surface conductrice pour la réaction de l'électrode. |
| Chlorure d'argent (AgCl) | Forme une couche stable et insoluble, contribuant à la stabilité de l'électrode. |
| Chlorure de potassium (KCl) | Agit comme électrolyte, facilitant la conduction ionique. |
Réaction de l'électrode
La réaction de l'électrode argent-chlorure d'argent peut être représentée comme suit :
[ \text{AgCl} + \text{e}^- \rightarrow \text{Ag} + \text{Cl}^- ]
Cette réaction met en évidence le transfert d'électrons du chlorure d'argent vers le fil d'argent, en maintenant un potentiel constant.
Applications
L'électrode argent-chlorure d'argent est fréquemment utilisée dans :
- Mesures potentiométriques:Electrode de référence fiable grâce à son potentiel stable.
- Surveillance de l'environnement:Pour des mesures précises du pH et de la concentration d'ions dans des solutions aqueuses.
- Applications médicales et biologiques:Dans les appareils nécessitant des potentiels électriques précis et stables.
En résumé, l'électrode argent-chlorure d'argent, tout comme l'électrode de glycure, joue un rôle crucial dans la catégorie des électrodes à sels insolubles métal-métal, offrant des solutions robustes pour divers besoins en chimie analytique.
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode électrochimique en carbone vitreux
- Électrode Électrochimique en Feuille d'Or Électrode en Or
- Électrode à disque d'or
- Électrode en feuille de platine pour applications de laboratoire et industrielles
Articles associés
- Comprendre les électrodes de référence au calomel saturé : Composition, utilisations et considérations
- Comment choisir la bonne électrode de référence pour votre application
- Guide du débutant pour comprendre les électrodes de référence en électrochimie
- Guide complet des électrodes de référence : Types, applications et critères de sélection
- Comment fabriquer votre propre électrode de référence Ag/AgCl pour des expériences électrochimiques

















