Définition et fonctions de base de la cellule électrolytique
Table des matières
Comprendre le rôle de l'énergie électrique et de l'énergie chimique dans une cellule électrolytique
Cellule électrochimique Une cellule électrochimique est un dispositif capable soit de générer de l'énergie électrique à partir de réactions chimiques, soit de faciliter des réactions chimiques par l'introduction d'énergie électrique.
Définir l'électrochimie L'électrochimie est l'étude des processus chimiques qui provoquent le déplacement des électrons. Il traite de l'interaction entre l'énergie électrique et le changement chimique.
Exemple : L'étude des cellules électrochimiques relève de l'électrochimie. Il s'agit de cellules qui convertissent l'énergie chimique en énergie électrique.
Importance de l'électrochimie L'électrochimie traite des relations entre les phénomènes électriques et chimiques. Les procédés électrochimiques sont utilisés dans diverses branches industrielles. Il s’agit du processus le plus important pour la production de plusieurs produits chimiques. La production de divers métaux est basée sur une méthode électrochimique. L'hydrogène est fabriqué par électrolyse de l'eau. Elle joue également un rôle majeur dans le développement de l’automobile électrique.
Description des composants d'une cellule électrolytique comprenant les électrodes et l'électrolyte
Les cellules électrolytiques sont composées de 3 composants essentiels.

L'anode est l'électrode négative ou réductrice qui libère des électrons vers le circuit externe et s'oxyde lors d'une réaction électrochimique.
La cathode est l'électrode positive ou oxydante qui acquiert les électrons du circuit externe et est réduite lors de la réaction électrochimique.
L'électrolyte est le milieu qui assure le mécanisme de transport des ions entre la cathode et l'anode d'une cellule. Les électrolytes sont souvent considérés comme des liquides, tels que l'eau ou d'autres solvants, contenant des sels, des acides ou des alcalis dissous, nécessaires à la conduction ionique. Il convient cependant de noter que de nombreuses piles, y compris les piles conventionnelles (AA/AAA/D), contiennent des électrolytes solides qui agissent comme conducteurs ioniques à température ambiante.
Considérations lors de la sélection de la cathode, de l'anode et de l'électrolyte
Les propriétés souhaitables pour les matériaux d'anode, de cathode et d'électrolyte sont indiquées ci-dessous.
Explication du processus de transfert de charge entre électrodes et ions
cellule électrolytique, tout appareil dans lequel l'énergie électrique est convertie en énergie chimique, ou vice versa. Une telle cellule est généralement constituée de deux conducteurs métalliques ou électroniques (électrodes) séparés l'un de l'autre et en contact avec un électrolyte (qv), généralement un composé ionique dissous ou fusionné. La connexion des électrodes à une source de courant électrique continu rend l’une chargée négativement et l’autre chargée positivement. Les ions positifs dans l'électrolyte migrent vers l'électrode négative (cathode) et s'y combinent avec un ou plusieurs électrons, perdant une partie ou la totalité de leur charge et devenant de nouveaux ions ayant une charge inférieure ou des atomes ou molécules neutres ; dans le même temps, les ions négatifs migrent vers l'électrode positive (anode) et y transfèrent un ou plusieurs électrons, devenant également de nouveaux ions ou particules neutres. L'effet global des deux processus est le transfert d'électrons des ions négatifs vers les ions positifs, une réaction chimique (voir réaction d'oxydo-réduction). Un exemple est l'électrolyse du chlorure de sodium (sel commun), formant du sodium métallique et du chlore gazeux ; l'énergie nécessaire au déroulement de la réaction est fournie par le courant électrique. D'autres applications courantes de l'électrolyse comprennent l'électrodéposition pour le raffinage ou le placage de métaux et la production de soude caustique.
Qu'est-ce qu'une cellule électrolytique ? Une cellule électrolytique peut être définie comme un dispositif électrochimique qui utilise l’énergie électrique pour faciliter une réaction redox non spontanée. Les cellules électrolytiques sont des cellules électrochimiques pouvant être utilisées pour l’électrolyse de certains composés. Par exemple, l’eau peut être soumise à une électrolyse (à l’aide d’une cellule électrolytique) pour former de l’oxygène gazeux et de l’hydrogène gazeux. Cela se fait en utilisant le flux d'électrons (dans l'environnement de réaction) pour surmonter la barrière énergétique d'activation de la réaction redox non spontanée.


Les trois principaux composants des cellules électrolytiques sont : La cathode (qui est chargée négativement pour les cellules électrolytiques) L'anode (qui est chargée positivement pour les cellules électrolytiques) L'électrolyte L'électrolyte fournit le milieu d'échange d'électrons entre la cathode et l'anode. Les électrolytes couramment utilisés dans les cellules électrolytiques comprennent l'eau (contenant des ions dissous) et le chlorure de sodium fondu.
CELLULES ÉLECTROLYTIQUES Pour définir les cellules électrolytiques, nous devons d'abord comprendre l'électrolyse. L'électrolyse est une méthode qui consiste à faire passer un courant électrique à travers un liquide contenant des ions, provoquant la désintégration des composés qu'il contient. Ceci est utilisé pour isoler le métal des éléments métalliques, séparer les autres substances chimiques (telles que l'eau) et galvaniser les métaux, et recharger les batteries. Un circuit complet est essentiel pour maintenir un processus électrolytique ; nous devons pouvoir tirer continuellement de l'électricité de la cellule.
La cathode et l'anode d'une cellule électrolytique sont connectées à une source d'alimentation. Ces deux électrodes stables et une solution électrolytique fluide se trouvent dans chaque cellule électrolytique. La solution électrolytique conduit l’électricité puisque les ions dissous peuvent se déplacer librement dans la solution.
Cellule électrolytique et ses composants La cellule électrolytique se compose de trois composants principaux : la batterie, les électrodes et l'électrolyte. Batterie La batterie fonctionne comme source d'alimentation. Il fournit l'énergie électrique nécessaire pour provoquer le changement chimique, c'est-à-dire la décomposition du composé ionique. Électrodes Les électrodes sont des contacts électriques qui ferment ou complètent le circuit électrique entre les fils et l'électrolyte. Des exemples d'électrodes comprennent des tiges de carbone (graphite) et des plaques métalliques. L'électrode de gauche (voir l'image ci-dessus) qui est connectée à la borne positive de la batterie est l'électrode positive ou l'anode. L'électrode de droite qui est connectée à la borne négative de la batterie est l'électrode négative ou cathode. Électrolyte L'électrolyte est une substance qui contient des ions mobiles lorsqu'elle est fondue ou en solution aqueuse, pour conduire l'électricité. Des exemples d'électrolytes comprennent le chlorure de sodium fondu, une solution de sulfate de cuivre (II) et des acides, tels que l'acide chlorhydrique dilué. Des exemples de non-électrolytes incluent les solutions sucrées, l'éthanol et le soufre (fondu), car ce sont des liquides ou des solutions qui ne contiennent pas d'ions mobiles pour conduire l'électricité.

Applications Les cellules électrolytiques sont souvent utilisées pour décomposer des composés chimiques, dans un processus appelé électrolyse, où électro signifie électricité et le mot grec lyse signifie briser. Des exemples importants d'électrolyse sont la décomposition de l'eau en hydrogène et en oxygène, et de la bauxite en aluminium et autres produits chimiques. La galvanoplastie (par exemple du cuivre, de l'argent, du nickel ou du chrome) est réalisée à l'aide d'une cellule électrolytique. L'électrolyse est une technique qui utilise un courant électrique continu (DC).
Commercialement, les cellules électrolytiques sont utilisées dans l’électroraffinage et l’électroextraction de plusieurs métaux non ferreux. La plupart de l’aluminium, du cuivre, du zinc et du plomb de haute pureté sont produits industriellement dans des cellules électrolytiques.
Une cellule électrolytique Les trois composants des cellules électrolytiques sont un électrolyte et deux électrodes.
Électrolytes Les électrolytes sont des substances qui donnent une solution électriquement conductrice lorsqu'elles sont dissoutes dans des solvants polaires, comme l'eau. En effet, lorsque l’électrolyte est dissous dans les solvants polaires, il se décompose en cations et anions et se répartit uniformément dans la solution. Ces cations et anions sous un potentiel électrique dans la solution se déplacent vers l'électrode avec respectivement une abondance d'électrons et un déficit d'électrons. Ce mouvement des cations et des anions dans la direction opposée génère du courant et forme les cellules électrolytiques.
Alors que les sels, les acides et les bases forment un électrolyte, peu de gaz, dans certaines conditions, peuvent également se comporter comme un électrolyte, comme le chlorure d'hydrogène à haute température et basse pression.
Réactions chimiques dans la cellule électrolytique
Explication de la réaction d'oxydo-réduction dans une cellule électrolytique
Dans les cellules électrochimiques, des réactions d'oxydo-réduction (redox) ont lieu. Il existe deux types de cellules électrochimiques : les cellules galvaniques (voltaïques), où se produisent des réactions spontanées, et les cellules électrolytiques, où se produisent des réactions non spontanées.
Les deux types de cellules possèdent des électrodes où se produisent des réactions d’oxydation et de réduction. L'oxydation se produit au niveau de l'électrode appelée anode et la réduction se produit au niveau de l'électrode appelée cathode.
Dans une cellule électrolytique, l’anode est positive et la cathode est négative. C'est parce que l'anode attire les anions de la solution. D'autre part, dans une cellule galvanique, l'anode est chargée négativement, car l'oxydation spontanée au niveau de l'anode est la source des électrons ou de la charge négative de la cellule. La cathode d'une cellule galvanique est sa borne positive.
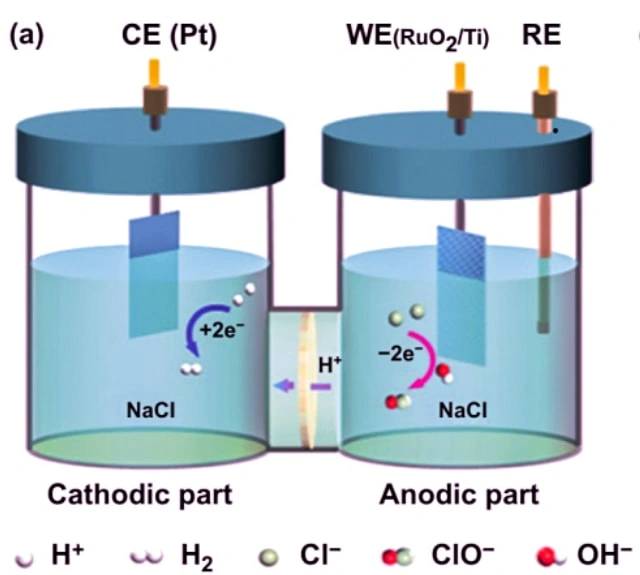
Exemple d'électrolyse du chlorure de sodium
Un exemple de cellule électrolytique est l'électrolyse du chlorure de sodium. Lorsque le chlorure de sodium est dissous dans l’eau et soumis à une électrolyse, les réactions suivantes se produisent :
A la cathode : 2 H2O + 2 e- -> 2 OH- + H2
A l'anode : 2 Cl- -> Cl2 + 2 e-
Réaction globale : 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
Dans cette cellule électrolytique, deux électrodes inertes sont immergées dans du chlorure de sodium fondu. Lorsqu’un courant électrique traverse le circuit, la cathode s’enrichit en électrons et développe une charge négative. Les ions sodium chargés positivement sont attirés vers la cathode, entraînant la formation de sodium métallique. Dans le même temps, les atomes de chlore sont attirés vers l’anode chargée positivement, conduisant à la formation de chlore gazeux. Le résultat global est la production de sodium métallique, de chlore gazeux et d’hydroxyde de sodium aqueux.
Applications des cellules électrolytiques
Les cellules électrolytiques ont diverses applications :
- Production d’oxygène gazeux et d’hydrogène gazeux à partir de l’eau.
- Extraction de l'aluminium de la bauxite.
- La galvanoplastie, qui consiste à former une fine couche protectrice d'un métal spécifique sur la surface d'un autre métal.
- Électroraffinage des métaux non ferreux.
- Processus de récupération électrolytique.
- La production industrielle de cuivre de haute pureté, de zinc de haute pureté et d’aluminium de haute pureté se fait presque toujours au moyen de cellules électrolytiques.
![Application de cellules électrolytiques (zinc de haute pureté, aluminium de haute pureté, cuivre de haute pureté)]()
Application de cellules électrolytiques (zinc de haute pureté, aluminium de haute pureté, cuivre de haute pureté)
Les cellules électrolytiques jouent un rôle crucial dans diverses industries et processus, permettant la production de produits chimiques et de matériaux importants.
Applications de l'électrolyse
Utilisation de l'électrolyse en électrodéposition pour l'affinage ou le placage de métaux
L'électrolyse est largement utilisée dans le processus d'électrodéposition pour l'affinage ou le placage des métaux. Une application pratique de l’électrolyse dans ce contexte est l’électronettoyage. Lors de l'électronettoyage, l'article à nettoyer, tel que le zinc ou l'aluminium, devient la cathode et un courant intense traverse une solution électrolytique. De la soude caustique et de l'hydrogène sont produits à la cathode, ce qui élimine efficacement la graisse et les impuretés de la surface de l'article. Ce procédé peut être utilisé pour affiner ou placage des métaux, en leur donnant un aspect propre et brillant, en les protégeant contre la corrosion et en remplaçant les matériaux usés.
Production de soude caustique par électrolyse
Une autre application importante de l’électrolyse concerne la production à grande échelle de produits chimiques, notamment de soude caustique (NaOH) et de chlore gazeux. Dans ce processus, l'électrolyse est utilisée pour décomposer le chlorure de sodium (NaCl) en ses éléments constitutifs, le sodium (Na) et le chlore (Cl2). La réaction à la cathode implique la réduction des ions sodium (Na+) en sodium métallique (Na), tandis qu'à l'anode, les ions chlorure (Cl-) sont oxydés pour former du chlore gazeux (Cl2). La réaction cellulaire globale est 2NaCl → 2Na + Cl2. Grâce à ce processus électrolytique, de grandes quantités de soude caustique et de chlore gazeux peuvent être produites pour diverses applications industrielles.
L'électrolyse dans l'extraction des métaux
L'électrolyse joue un rôle crucial dans l'extraction des métaux de leurs minerais. Il existe deux méthodes principales d’extraction des métaux par électrolyse. Dans la première méthode, le minerai est traité avec un acide fort pour obtenir un sel, et la solution saline résultante est électrolysée pour libérer le métal. Dans la deuxième méthode, le minerai est à l’état fondu et est directement électrolysé dans un four.
Un exemple d’extraction de métaux par électrolyse est l’extraction du zinc. Le minerai de zinc est traité avec de l'acide sulfurique pour former une solution de sulfate de zinc, qui est ensuite électrolysée. Dans la cuve électrolytique, des cathodes en aluminium et des anodes en plomb sont utilisées. Le zinc se dépose sur les cathodes, tandis que l'acide sulfurique est régénéré au niveau des anodes. Ce processus électrolytique permet l’extraction de zinc de haute pureté.
De même, l’électrolyse est également utilisée dans l’extraction de l’aluminium de la bauxite. La bauxite, un minerai d'aluminium, est dissoute dans de la cryolite fondue et soumise à une électrolyse. Les ions aluminium sont réduits à la cathode, formant de l'aluminium métallique, tandis que de l'oxygène gazeux est produit à l'anode. Ce procédé permet la production d'aluminium de haute pureté.

Dans l’ensemble, l’électrolyse trouve des applications pratiques dans diverses industries pour l’extraction, le raffinage et le placage des métaux, ainsi que pour la production de produits chimiques tels que la soude caustique. En exploitant la puissance de l’électrolyse, les entreprises peuvent obtenir des résultats de haute qualité et répondre aux demandes de leurs secteurs respectifs.
Conversion de l'énergie chimique en électricité
Explication de la génération d'énergie dans des réactions impliquant des substances génératrices d'énergie
Dans les cellules électrochimiques, l’énergie chimique est convertie en énergie électrique grâce à un processus appelé électrolyse. L'électrolyse est une réaction redox qui se produit dans une cellule électrochimique, où des substances chimiques sont décomposées au niveau des électrodes. Les produits de l'électrolyse dépendent du type d'électrode et d'électrolyte utilisé dans la cellule. Ce processus est à la base de diverses applications en électrochimie.
Le domaine de l'électrochimie implique la production d'électricité à partir de l'énergie libérée lors de réactions chimiques spontanées, ainsi que l'utilisation de l'énergie électrique pour provoquer des changements chimiques non spontanés. Les réactions redox, qui impliquent le transfert d’électrons entre espèces, sont au cœur de ces processus. De nombreuses réactions chimiques et biologiques sont des réactions redox et jouent un rôle crucial dans l’obtention d’énergie à des fins domestiques, de transport ou industrielles.
L'énergie générée par ces réactions est utilisée dans un large éventail d'applications, notamment la combustion de combustibles pour la digestion des aliments chez les animaux, les processus industriels, la photosynthèse, l'extraction de métaux à partir de minerais, la fabrication de produits chimiques importants et le fonctionnement de batteries et de piles à combustible.
Exemple d'accumulateur au plomb
Un exemple de conversion de l’énergie chimique en électricité est la batterie d’accumulateurs au plomb. Ce type de batterie est couramment utilisé comme source d’énergie dans les véhicules. Il se compose de plusieurs cellules électrochimiques reliées entre elles.

La batterie au plomb fonctionne à la fois comme une cellule électrolytique et une cellule galvanique. Lors de la décharge, il agit comme une cellule galvanique, convertissant l'énergie chimique en énergie électrique. Pendant le processus de décharge, le dioxyde de plomb, le plomb métallique et l'acide sulfurique réagissent pour former du sulfate de plomb et de l'eau. L’oxydation du plomb en sulfate de plomb se produit au niveau d’une électrode, tandis que la réduction du dioxyde de plomb en sulfate de plomb se produit au niveau de l’autre électrode. La charge électrique est transportée à travers l'électrolyte par la migration des ions hydrogène.
Cette séparation des processus d'oxydation et de réduction crée une force motrice, ou une tension, qui fait circuler l'électricité à travers un circuit externe reliant les deux électrodes. De nombreuses autres combinaisons chimiques ont été utilisées dans les piles et les batteries, chacune ayant ses propres réactions et caractéristiques spécifiques.
Réservoirs de carburant
Les piles à combustible sont un autre type de pile électrochimique qui convertit l'énergie chimique du combustible en électricité. Ces cellules fonctionnent grâce à une réaction électrochimique entre l’hydrogène et un agent oxydant, généralement l’oxygène. Contrairement aux batteries, qui génèrent de l’énergie à partir de produits chimiques déjà contenus dans elles, les piles à combustible nécessitent un flux continu d’oxygène et un approvisionnement en carburant pour produire de l’électricité.
Les piles à combustible ont été utilisées commercialement par la NASA pour produire de l'énergie pour les capsules spatiales et les satellites. Ils offrent des avantages en termes d'efficacité thermodynamique, car ils évitent les pertes du cycle de Carnot. Cependant, la technologie actuelle des piles à combustible reste confrontée à des défis en termes d’efficacité et de fiabilité globales. L’une des limites est l’incapacité d’utiliser directement les hydrocarbures, ce qui nécessite une étape de traitement pour convertir les carburants courants en hydrogène. De plus, la catalyse de la réduction de l’oxygène est un processus complexe.

En résumé, la conversion de l’énergie chimique en électricité est un processus fondamental en électrochimie. Cela se produit par des réactions redox dans les cellules électrochimiques, telles que les batteries de stockage au plomb et les piles à combustible. Ces technologies ont diverses applications, depuis l’alimentation des véhicules jusqu’à la production d’électricité pour l’exploration spatiale.
Cellules alternatives pour produire de l’électricité
Comprendre les cellules solaires et le rôle des semi-conducteurs et de l'absorption de la lumière
- Le silicium amorphe (A-Si) est un matériau photovoltaïque à couche mince dominant qui a une capacité d'absorption de la lumière environ 40 fois supérieure à celle du silicium cristallin.
- Le tellurure de cadmium (CdTe) est un autre matériau en couche mince doté d'une capacité d'absorption de la lumière élevée. Il peut absorber 90 % du spectre solaire avec seulement un film mince de 1 mm.
- Le diséléniure de cuivre et d'indium (CIGS) est un matériau semi-conducteur qui a atteint un rendement élevé dans les photovoltaïques, les modules commerciaux atteignant des rendements de 14 % ou plus.

Explication des piles à combustible et de leur utilisation d'agents oxydants et réducteurs
- Les piles à combustible sont des cellules électrochimiques qui réagissent avec de l'hydrogène ou un autre agent oxydant pour convertir l'énergie chimique en électricité.
- Elles diffèrent des batteries car elles nécessitent une source continue de carburant et d’oxygène pour entretenir la réaction chimique.
- Les piles à combustible peuvent produire de l’électricité en continu tant que du carburant et de l’oxygène sont fournis.
- Ils sont utilisés pour l'alimentation principale et de secours dans diverses applications, notamment les bâtiments commerciaux, industriels, résidentiels et les zones éloignées.
- Les piles à combustible sont également utilisées pour alimenter des véhicules à pile à combustible comme les chariots élévateurs, les automobiles, les bus, les bateaux, les motos et les sous-marins.
- Le marché mondial des piles à combustible devrait croître de 19,9 % d’ici 2030.
Autres cellules pour produire de l'électricité
- Les cellules solaires produisent de l'électricité grâce à l'absorption de la lumière par des semi-conducteurs.
- Les piles à combustible utilisent l'énergie chimique du carburant pour produire de l'électricité.
- Les piles rechargeables peuvent être utilisées plusieurs fois en les rechargeant.
- Les piles non rechargeables ne peuvent pas être réutilisées et doivent être éliminées.
- Les batteries d’accumulateurs au plomb/plomb sont des cellules secondaires utilisées comme source d’énergie dans les véhicules.
- Les cellules à couches minces, telles que les cellules solaires à couches minces, les transistors à couches minces et les batteries à couches minces, offrent une efficacité améliorée, une charge plus rapide et une durée de vie plus longue que les cellules conventionnelles.
Le domaine des cellules alternatives pour produire de l’électricité est en constante évolution. Les chercheurs continuent d’améliorer l’efficacité et les propriétés des matériaux en couches minces, tandis que les experts de l’industrie s’efforcent de réduire les coûts et d’augmenter la production.
Si vous êtes intéressé par ce produit, vous pouvez consulter le site Web de notre entreprise : https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple , nous insistons toujours sur le principe de qualité en premier. Pendant le processus de production, nous contrôlons strictement chaque étape du processus, en utilisant des matériaux de haute qualité et une technologie de production avancée pour garantir la stabilité et la durabilité de nos produits. pour garantir que leurs performances répondent aux normes les plus élevées. Nous pensons que ce n'est qu'en fournissant aux clients une excellente qualité que nous pouvons gagner leur confiance et leur coopération à long terme.
Produits associés
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique à électrolyse spectrale en couche mince
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
- Électrode en feuille de platine pour applications de laboratoire et industrielles
Articles associés
- Comprendre les cellules électrolytiques et leur rôle dans la purification et la galvanoplastie du cuivre
- Surmonter les défis avec le fonctionnement des cellules électrolytiques de type H
- Comprendre les cellules électrolytiques à quartz : Applications, mécanismes et avantages
- Applications de la cellule électrolytique de type H dans l'extraction des métaux
- Le Dialogue Silencieux : Maîtriser le Contrôle dans les Cellules Électrolytiques

















