Introduction aux cellules électrolytiques et à la corrosion
Les cellules électrolytiques jouent un rôle essentiel dans divers processus industriels, mais elles ne sont pas exemptes de défis, notamment en termes de corrosion. Cet article se penche sur le fonctionnement complexe des cellules électrolytiques à corrosion plane, en explorant leurs composants fondamentaux tels que l'électrolyte, l'anode et la cathode, ainsi que les processus qui conduisent à la corrosion. La compréhension de ces mécanismes est essentielle pour développer des stratégies efficaces visant à atténuer la corrosion et à garantir la longévité et l'efficacité des cellules électrolytiques dans des applications allant de la purification des métaux à la galvanoplastie. Rejoignez-nous pour découvrir les complexités des cellules électrolytiques et les mesures critiques nécessaires à la protection de ces outils industriels essentiels.
Mécanismes de corrosion dans les cellules électrolytiques
La corrosion dans les cellules électrolytiques est un processus complexe qui implique l'interaction de divers facteurs, notamment la fluctuation des potentiels et la dissemblance entre les électrodes métalliques. Il est essentiel de comprendre ces mécanismes pour élaborer des stratégies efficaces visant à atténuer la corrosion, qui peut avoir un impact significatif sur l'efficacité et la durée de vie des cellules électrolytiques.
Rôle des potentiels fluctuants
Les fluctuations de potentiel dans les cellules électrolytiques peuvent provenir de plusieurs sources, notamment des variations de la tension appliquée, des changements dans la composition de l'électrolyte et des fluctuations thermiques. Ces fluctuations peuvent entraîner une corrosion localisée, où certaines zones de l'électrode subissent des taux d'oxydation ou de réduction plus élevés que d'autres. Cette corrosion non uniforme peut entraîner des piqûres, une corrosion par crevasses et d'autres formes de dommages localisés.
Par exemple, dans une cellule électrolytique typique, l'anode subit une oxydation, libérant des électrons, tandis que la cathode subit une réduction, acceptant des électrons. Si le potentiel de l'anode fluctue, il peut en résulter des taux d'oxydation inégaux, entraînant la corrosion de certaines zones plus rapidement que d'autres. De même, les fluctuations de potentiel à la cathode peuvent affecter le processus de réduction, entraînant des schémas de corrosion non uniformes.
Interaction entre différentes électrodes métalliques
L'utilisation d'électrodes métalliques différentes dans une cellule électrolytique peut également contribuer à la corrosion. Lorsque deux métaux différents sont en contact l'un avec l'autre dans une solution électrolytique, ils peuvent former une cellule galvanique, où un métal agit comme anode et l'autre comme cathode. Le métal dont le potentiel d'oxydation est le plus élevé se corrodera plus rapidement, jouant le rôle d'anode sacrificielle.
Par exemple, si une électrode de cuivre est utilisée avec une électrode de zinc dans un électrolyte acide, le zinc se corrodera plus rapidement en raison de son potentiel d'oxydation plus élevé. Cette corrosion galvanique peut être exacerbée par les fluctuations du pH, de la température et de la concentration ionique de l'électrolyte, ce qui accélère la dégradation de l'anode sacrificielle.
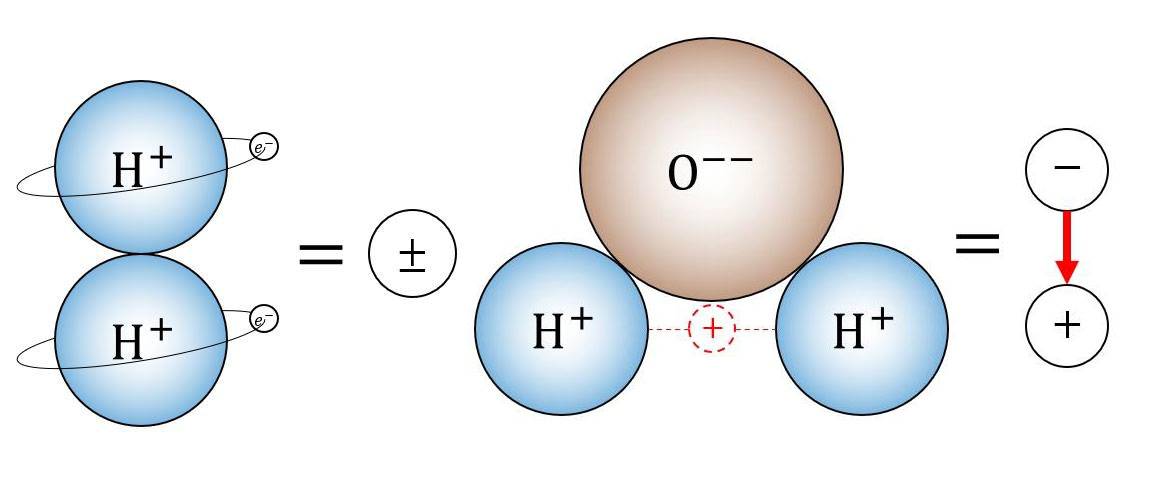
Stratégies d'atténuation
Pour atténuer la corrosion dans les cellules électrolytiques, plusieurs stratégies peuvent être employées :
-
Protection cathodique: Il s'agit d'utiliser un métal plus réactif comme anode sacrificielle pour protéger l'électrode primaire de la corrosion. L'anode sacrificielle se corrode à la place de l'électrode primaire, ce qui prolonge sa durée de vie.
-
Inhibiteurs: Des inhibiteurs chimiques peuvent être ajoutés à l'électrolyte pour réduire la vitesse de corrosion. Ces inhibiteurs forment une couche protectrice à la surface de l'électrode, empêchant tout contact direct avec les espèces corrosives. Les inhibiteurs les plus courants sont les composés organiques contenant des atomes d'azote, de soufre ou d'oxygène.
-
Sélection des matériaux: Le choix de matériaux résistants à la corrosion pour les électrodes peut réduire considérablement les taux de corrosion. Par exemple, le platine et l'or sont très résistants à la corrosion et sont souvent utilisés dans des applications électrolytiques exigeantes.
-
Conception des électrodes: L'optimisation de la conception des électrodes peut également contribuer à réduire la corrosion. Par exemple, l'utilisation d'électrodes bipolaires, qui agissent à la fois comme anode et cathode dans différentes cellules, peut minimiser la différence de potentiel entre les électrodes et réduire la corrosion galvanique.
-
Entretien et surveillance: Un contrôle régulier des performances de la cellule électrolytique permet d'identifier les premiers signes de corrosion. Un entretien périodique, tel que le nettoyage des électrodes et le remplacement de l'électrolyte, peut empêcher l'accumulation de sous-produits corrosifs et garantir des performances optimales.
Conclusion
La corrosion dans les cellules électrolytiques est un problème à multiples facettes qui implique l'interaction de potentiels fluctuants et l'interaction entre différentes électrodes métalliques. En comprenant ces mécanismes, il est possible de développer des stratégies efficaces pour atténuer la corrosion et améliorer ainsi l'efficacité et la longévité des cellules électrolytiques. En choisissant soigneusement les matériaux, en optimisant la conception et en utilisant des mesures de protection telles que les inhibiteurs et la protection cathodique, il est possible de réduire de manière significative l'impact de la corrosion sur les systèmes électrolytiques.
Applications industrielles des cellules électrolytiques
Les cellules électrolytiques jouent un rôle crucial dans divers processus industriels, de la purification des métaux à la production chimique. Ces cellules utilisent les principes de l'électrolyse, où un courant électrique passe à travers un liquide ou une solution contenant des ions pour entraîner des réactions chimiques non spontanées. Cette section examine les applications industrielles spécifiques des cellules électrolytiques, en se concentrant sur la purification du cuivre, la galvanoplastie et la production de soude caustique, tout en soulignant l'importance de la prévention de la corrosion.
Purification du cuivre
L'une des applications les plus importantes des cellules électrolytiques est la purification du cuivre. Le processus implique l'utilisation d'une cellule électrolytique dont l'anode est constituée de cuivre impur et la cathode d'une fine feuille de cuivre pur. L'électrolyte est une solution de sulfate de cuivre (CuSO4) et d'acide sulfurique (H2SO4). Lorsqu'un courant électrique est appliqué, les ions cuivre (Cu2+) de l'anode se dissolvent dans l'électrolyte et migrent ensuite vers la cathode, où ils se déposent sous forme de cuivre pur. Ce processus permet d'obtenir des niveaux de pureté du cuivre supérieurs à 99,9 %.
La consommation d'énergie pour le raffinage du cuivre par des procédés électrolytiques varie de 150 à 300 kilowattheures par tonne de cuivre raffiné. Cette méthode est très efficace et garantit que les impuretés telles que le fer et le zinc restent dans l'électrolyte, tandis que les métaux précieux tels que l'or et l'argent s'accumulent au fond de la cellule sous forme de boue anodique, qui peut être récupérée.

Placage électrolytique
La galvanoplastie est une autre application essentielle des cellules électrolytiques, où une fine couche d'un métal est déposée sur la surface d'un autre métal pour en améliorer l'apparence, la durabilité ou la résistance à la corrosion. Les métaux couramment utilisés en galvanoplastie sont le chrome, le nickel et l'or. Le processus consiste à immerger l'objet à revêtir (cathode) et une barre du métal de revêtement (anode) dans une solution électrolytique contenant des ions métalliques. Lorsqu'un courant électrique est appliqué, les ions métalliques de l'électrolyte sont réduits à la cathode, formant un revêtement uniforme.
La galvanoplastie est largement utilisée dans les secteurs de l'automobile, de l'aérospatiale et de l'électronique. Par exemple, le chromage est utilisé pour donner une finition dure et brillante aux pièces automobiles, tandis que le placage d'or est essentiel pour les composants électroniques afin de garantir une bonne conductivité électrique et une bonne résistance à la corrosion.
Production de soude caustique
La production de soude caustique (hydroxyde de sodium, NaOH) est une autre application industrielle importante des cellules électrolytiques. La soude caustique est un produit chimique essentiel dans diverses industries, notamment la fabrication du papier, la production de savon et de détergents et le traitement de l'eau. Le processus implique l'électrolyse d'une solution de chlorure de sodium (NaCl), communément appelée saumure.
Dans la cellule électrolytique, du chlore gazeux (Cl2) est produit à l'anode et de l'hydroxyde de sodium est produit à la cathode. La réaction globale peut être résumée comme suit :
[ 2NaCl + 2H2O \rightarrow 2NaOH + Cl2 + H2 ]
Le chlore gazeux est souvent utilisé dans la production d'autres produits chimiques, tels que le PVC (chlorure de polyvinyle), tandis que la soude caustique est utilisée dans de nombreux processus industriels. Cette méthode de production est très efficace et se fait à grande échelle, avec des millions de tonnes de soude caustique produites chaque année dans le monde.
Prévention de la corrosion
La prévention de la corrosion est un aspect essentiel de nombreuses applications industrielles impliquant des cellules électrolytiques. La corrosion se produit lorsqu'un métal réagit avec son environnement, entraînant une dégradation et une perte des propriétés du matériau. Les cellules électrolytiques peuvent être utilisées pour appliquer des revêtements protecteurs sur les métaux, tels que le zinc ou le cadmium, qui constituent une barrière contre les facteurs environnementaux.
En outre, les cellules électrolytiques sont utilisées dans le processus de protection cathodique, où une anode sacrificielle est connectée à la structure métallique à protéger. L'anode sacrificielle se corrode à la place de la structure protégée, ce qui prolonge sa durée de vie. Cette méthode est couramment utilisée pour la protection des pipelines, des structures offshore et des réservoirs de stockage.
En conclusion, les cellules électrolytiques sont indispensables dans divers processus industriels, de la purification des métaux à la galvanoplastie, en passant par la production chimique et la prévention de la corrosion. Ces applications soulignent la polyvalence et l'importance des cellules électrolytiques dans l'industrie moderne, garantissant la production de matériaux de haute qualité et le fonctionnement efficace des processus industriels.
Mesures préventives contre la corrosion
La corrosion dans les cellules d'électrolyse est une préoccupation importante en raison de son potentiel de dégradation des performances et de la durée de vie de l'équipement. Diverses techniques ont été mises au point pour prévenir ou atténuer la corrosion, notamment l'utilisation d'inhibiteurs, la protection cathodique et la formation de couches de passivation. Ces méthodes sont essentielles pour maintenir l'intégrité et l'efficacité des processus électrolytiques, qui sont largement utilisés dans des industries telles que la galvanoplastie, l'affinage des métaux et le traitement de l'eau.
Utilisation d'inhibiteurs
Les inhibiteurs sont des produits chimiques qui, ajoutés à l'électrolyte, peuvent réduire de manière significative la vitesse de corrosion des électrodes. Ces substances agissent en formant une couche protectrice à la surface du métal, qui agit comme une barrière contre l'environnement corrosif. L'efficacité des inhibiteurs dépend de plusieurs facteurs, notamment de leur concentration, du type de métal et de la composition de l'électrolyte. Par exemple, certains composés organiques contenant des atomes d'azote, de soufre ou d'oxygène peuvent être des inhibiteurs très efficaces en raison de leur capacité à s'adsorber sur la surface du métal et à bloquer les sites actifs où la corrosion se produit généralement.
Protection cathodique
La protection cathodique est une autre méthode efficace pour prévenir la corrosion dans les cellules électrolytiques. Cette technique consiste à faire de la surface métallique la cathode d'une cellule électrochimique, la protégeant ainsi de l'oxydation. Il existe deux principaux types de protection cathodique : les anodes sacrificielles et le courant imposé. Dans les systèmes à anode sacrificielle, un métal plus réactif (comme le zinc ou le magnésium) est connecté au métal à protéger. L'anode sacrificielle se corrode à la place du métal protégé. Dans les systèmes à courant imposé, une source d'énergie externe est utilisée pour fournir un courant continu à la cathode, ce qui l'empêche de s'oxyder.
Formation de couches de passivation
La formation de couches de passivation est un processus naturel au cours duquel une fine couche protectrice d'oxyde ou d'autres composés se forme à la surface du métal. Cette couche agit comme une barrière qui empêche la poursuite de la corrosion en bloquant l'accès au métal sous-jacent. La passivation peut être renforcée par l'utilisation de traitements spécifiques, tels que l'anodisation pour l'aluminium ou la chromatation pour l'acier. Ces traitements créent non seulement une couche protectrice, mais améliorent également les propriétés mécaniques du métal, le rendant plus résistant à l'usure.
La galvanoplastie
La galvanoplastie est un procédé qui consiste à déposer une fine couche de métal sur une autre surface métallique afin de la protéger contre la corrosion. Ce procédé consiste à immerger la pièce métallique dans une solution contenant le métal à déposer et à appliquer un courant électrique. Les ions métalliques de la solution sont réduits à la cathode (la pièce métallique), formant ainsi une couche protectrice. Les métaux couramment utilisés pour la galvanoplastie sont le chrome, le nickel et le zinc. La galvanoplastie offre non seulement une protection contre la corrosion, mais améliore également l'aspect et la résistance à l'usure des pièces métalliques.
Les cellules électrolytiques dans l'industrie
Les cellules électrolytiques sont largement utilisées dans divers processus industriels, notamment pour la production de métaux de haute pureté tels que l'aluminium, le cuivre, le zinc et le plomb. Ces cellules sont également utilisées dans l'affinage électrolytique et l'extraction électrolytique des métaux, où la pureté du produit final est essentielle. En outre, les cellules d'électrolyse sont utilisées dans les processus de traitement de l'eau, tels que la décomposition de l'eau en hydrogène et en oxygène. La prévention de la corrosion dans ces cellules est essentielle pour assurer le fonctionnement continu et efficace de ces processus.
Conclusion
La prévention de la corrosion dans les cellules électrolytiques est cruciale pour la longévité et les performances des équipements industriels. Des techniques telles que l'utilisation d'inhibiteurs, la protection cathodique et la formation de couches de passivation sont des stratégies efficaces pour atténuer la corrosion. Ces méthodes permettent non seulement de protéger les électrodes, mais aussi d'assurer le bon fonctionnement des processus électrolytiques, qui sont vitaux pour diverses applications industrielles. En mettant en œuvre ces mesures préventives, les industries peuvent réduire les coûts de maintenance, prolonger la durée de vie de leurs équipements et maintenir des normes de production de haute qualité.
Conception et matériaux des cellules électrolytiques
Les cuves d'électrolyse sont fondamentales dans divers processus industriels, en particulier dans l'affinage électrolytique et l'extraction électrolytique de métaux non ferreux tels que l'aluminium, le cuivre, le zinc et le plomb. Ces cellules sont conçues pour faciliter la décomposition des composés chimiques par l'application de l'énergie électrique, un processus qui ne se produirait pas spontanément dans des conditions normales. L'efficacité d'une cellule électrolytique dépend fortement de sa conception et des matériaux utilisés, en particulier de la sélection d'électrodes inertes et de la nature de l'électrolyte.
Composants des cellules électrolytiques
Une cellule électrolytique se compose de trois éléments principaux : l'électrolyte, la cathode et l'anode.
-
L'électrolyte: Il s'agit généralement d'une solution d'eau ou d'autres solvants dans laquelle les ions sont dissous. Les sels fondus, tels que le chlorure de sodium, peuvent également servir d'électrolytes. Le rôle de l'électrolyte est crucial car il contient les ions qui participent aux réactions d'oxydoréduction lorsqu'une tension externe est appliquée. Les ions de l'électrolyte se déplacent vers les électrodes de charge opposée, facilitant ainsi les réactions de transfert de charge.
-
Cathode et anode: La cathode est l'électrode négative où se produit la réduction, tandis que l'anode est l'électrode positive où se produit l'oxydation. Dans les cellules électrolytiques, il est préférable d'utiliser des électrodes inertes afin d'éviter toute réaction chimique susceptible d'altérer les électrodes elles-mêmes. Les matériaux couramment utilisés pour ces électrodes sont le graphite et le platine, connus pour leur stabilité et leur conductivité.

Considérations relatives à la conception
La conception d'une cellule électrolytique doit tenir compte de plusieurs facteurs afin d'optimiser ses performances :
-
Sélection du matériau de l'électrode: Le choix du matériau de l'électrode est essentiel. Les anodes doivent être des agents réducteurs efficaces avec un rendement coulombien élevé, une bonne conductivité, une stabilité, une facilité de fabrication et un faible coût. Les matériaux d'anode les plus courants sont le zinc et le lithium. Les cathodes, quant à elles, doivent être des agents oxydants efficaces, stables au contact de l'électrolyte et avoir une tension de fonctionnement utile. Les oxydes métalliques sont souvent utilisés à cette fin.
-
Composition de l'électrolyte: L'électrolyte doit être soigneusement choisi pour garantir qu'il favorise les réactions chimiques souhaitées sans provoquer d'effets secondaires indésirables tels que la corrosion ou la dégradation des électrodes. La conductivité de l'électrolyte est également un facteur clé, car elle influence directement l'efficacité de la cellule.
-
Géométrie de la cellule: La disposition physique des électrodes et de l'électrolyte peut affecter de manière significative le flux d'ions et la distribution du courant dans la cellule. L'optimisation de la géométrie de la cellule peut contribuer à minimiser les pertes d'énergie et à améliorer l'efficacité globale du processus électrolytique.
Applications et impact
La conception et les matériaux des cellules électrolytiques ont un impact profond sur leurs applications dans l'industrie. Par exemple, la production de métaux de haute pureté comme l'aluminium et le cuivre dépend fortement de l'efficacité de ces cellules. En outre, les cellules électrolytiques sont utilisées dans des processus tels que la purification de l'eau et la production d'hydrogène, ce qui démontre leur polyvalence et leur importance dans la technologie moderne.
En conclusion, la conception et les matériaux des cellules électrolytiques sont essentiels à leur fonctionnement et à leur efficacité. En choisissant soigneusement des électrodes inertes et en optimisant l'électrolyte et la géométrie de la cellule, il est possible d'améliorer les performances de ces cellules, ce qui les rend plus efficaces dans une large gamme d'applications industrielles.
Cellules électrolytiques et galvaniques
Les cellules électrolytiques et galvaniques sont des composants fondamentaux dans le domaine de l'électrochimie, chacune servant des objectifs distincts et fonctionnant selon des principes différents. Il est essentiel de comprendre les différences et les applications de ces cellules pour divers processus scientifiques et industriels.

Différences de fonctionnement
Cellules électrolytiques : Les cellules électrolytiques sont utilisées pour provoquer des réactions chimiques non spontanées par l'application de l'énergie électrique. Elles se composent de deux électrodes (anode et cathode) immergées dans une solution électrolytique. Dans ces cellules, la source d'énergie externe force les électrons à entrer dans la cathode, ce qui la rend négative, et attire les électrons de l'anode, ce qui la rend positive. Cette configuration inverse le flux naturel d'électrons, ce qui permet l'apparition de réactions non spontanées.
Cellules galvaniques : En revanche, les piles galvaniques génèrent de l'énergie électrique à partir de réactions chimiques spontanées. Elles se composent également de deux électrodes immergées dans un électrolyte, mais contrairement aux cellules électrolytiques, elles ne nécessitent pas de source d'énergie externe. L'anode, où se produit l'oxydation, est chargée négativement, et la cathode, où se produit la réduction, est chargée positivement. Le flux d'électrons de l'anode à la cathode à travers un circuit externe génère un courant électrique.
Applications
Cellules électrolytiques : Les cellules électrolytiques sont largement utilisées dans les processus industriels tels que l'électrolyse de l'eau pour produire de l'hydrogène et de l'oxygène, la galvanoplastie des métaux et le raffinage du cuivre. Elles sont également cruciales pour la production de produits chimiques tels que la soude caustique et le chlore. Leur capacité à entraîner des réactions non spontanées les rend indispensables dans divers processus de synthèse et de purification chimiques.
Cellules galvaniques : Les piles galvaniques sont à la base des batteries, où l'énergie des réactions d'oxydoréduction spontanées est exploitée pour fournir de l'énergie électrique. Les exemples les plus courants sont les piles primaires, comme les piles alcalines et les piles zinc-carbone, et les piles secondaires, comme les piles plomb-acide et les piles lithium-ion. Ces piles sont essentielles pour alimenter les appareils électroniques portables, les véhicules et les systèmes d'alimentation de secours.
Impact sur les taux de corrosion et les stratégies de prévention
Les différences de fonctionnement entre les cellules électrolytiques et galvaniques affectent de manière significative les taux de corrosion et les stratégies de prévention. Dans la corrosion galvanique, deux métaux différents en contact l'un avec l'autre et avec un électrolyte forment une cellule galvanique, ce qui accélère la corrosion du métal le moins noble. Ce phénomène est exploité dans les systèmes d'anodes sacrificielles utilisés pour protéger de la corrosion des structures telles que les navires et les pipelines.
Les cellules électrolytiques, quant à elles, peuvent être utilisées dans les méthodes de protection cathodique, où une structure métallique est reliée à un métal plus réactif (anode sacrificielle) et immergée dans un électrolyte. Le métal plus réactif se corrode à la place de la structure protégée, ce qui empêche efficacement la corrosion.

Conclusion
En résumé, bien que les cellules électrolytiques et galvaniques impliquent toutes deux des réactions d'oxydoréduction et possèdent des électrodes où se produisent l'oxydation et la réduction, elles fonctionnent de manière opposée. Les cellules électrolytiques utilisent une énergie électrique externe pour entraîner des réactions non spontanées, tandis que les cellules galvaniques génèrent de l'énergie électrique à partir de réactions spontanées. Il est essentiel de comprendre ces différences pour une application efficace dans divers contextes scientifiques, industriels et d'ingénierie, en particulier pour la gestion de la corrosion et sa prévention.
Tendances futures et innovations dans la technologie des cellules électrolytiques
Le domaine de la technologie des cellules électrolytiques est sur le point de connaître des avancées significatives, motivées par la nécessité de disposer de systèmes plus durables et plus efficaces, en particulier dans le contexte du développement des batteries et des processus d'affinage des métaux. Ces innovations visent à relever des défis cruciaux tels que la corrosion, l'efficacité énergétique et l'extensibilité des processus électrolytiques.
Améliorer la durabilité grâce à la science des matériaux
La corrosion reste un problème important dans les cellules électrolytiques, en particulier dans les environnements où les potentiels fluctuent et où les métaux sont différents. Les chercheurs explorent diverses méthodes pour atténuer la corrosion, notamment l'utilisation d'inhibiteurs et le développement de nouveaux matériaux intrinsèquement plus résistants à la corrosion. L'inhibition cathodique, par exemple, est une technique qui forme une couche protectrice sur la cathode, réduisant ainsi la vitesse de la corrosion. Cette méthode permet non seulement de ralentir la réaction cathodique, mais aussi de précipiter dans ces zones, protégeant ainsi l'électrode contre d'autres dommages.
Innovations dans la conception des cellules électrolytiques
La conception des cellules électrolytiques connaît également des changements importants. Les modèles traditionnels reposent sur un circuit complet avec des électrodes stables et une solution électrolytique fluide. Cependant, de nouvelles conceptions explorent l'utilisation d'électrolytes solides qui peuvent fonctionner à des températures extrêmes, offrant une stabilité et des performances accrues. Ces électrolytes solides pourraient permettre aux batteries à haute densité énergétique d'avoir une durée de vie beaucoup plus longue, ce qui les rendrait adaptées à une large gamme d'applications allant des véhicules électriques au stockage en réseau.
Efficacité énergétique et durabilité
L'amélioration de l'efficacité énergétique des cellules électrolytiques est un autre domaine d'intérêt essentiel. Il s'agit d'optimiser les processus électriques et chimiques au sein de la cellule afin de réduire les pertes d'énergie et d'améliorer les performances globales. Les chercheurs s'intéressent également à des matériaux et à des procédés plus durables, afin de réduire l'impact des cellules électrolytiques sur l'environnement. Par exemple, le développement d'électrolytes d'origine biologique et le recyclage des matériaux utilisés dans les cellules d'électrolyse sont de plus en plus considérés comme des alternatives durables.
Conclusion
L'avenir de la technologie des cellules enologie des cellules électrolytiques est prometteur, avec de nombreuses innovations à l'horizon qui promettent d'améliorer la durabilité, l'efficacité et la viabilité. Les progrès réalisés dans le domaine du développement des électrolytes, de la science des matériaux, de la conception des cellules et de l'efficacité énergétique ouvrent la voie à des cellules électrolytiques plus robustes et plus polyvalentes. Ces progrès permettent non seulement de relever les défis techniques, mais contribuent également à la réalisation d'objectifs environnementaux plus larges en favorisant des solutions énergétiques plus propres et plus durables. Au fur et à mesure que la recherche évolue, l'impact de ces innovations se fera sentir dans diverses industries, du stockage de l'énergie à l'affinage des métaux, ce qui permettra de progresser vers un avenir plus durable.
Produits associés
- Cellule électrochimique de corrosion plane
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique à électrolyse spectrale en couche mince
- Cellule électrolytique électrochimique à bain-marie double couche
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
Articles associés
- Applications de la cellule électrolytique de type H dans l'extraction des métaux
- Applications des cellules électrolytiques dans la purification et la galvanoplastie
- Techniques avancées de cellule électrolytique pour la recherche de pointe en laboratoire
- Techniques avancées d'évaluation des revêtements à l'aide de cellules électrolytiques
- Exploration du bain-marie multifonctionnel pour cellules électrolytiques : Applications et avantages
















