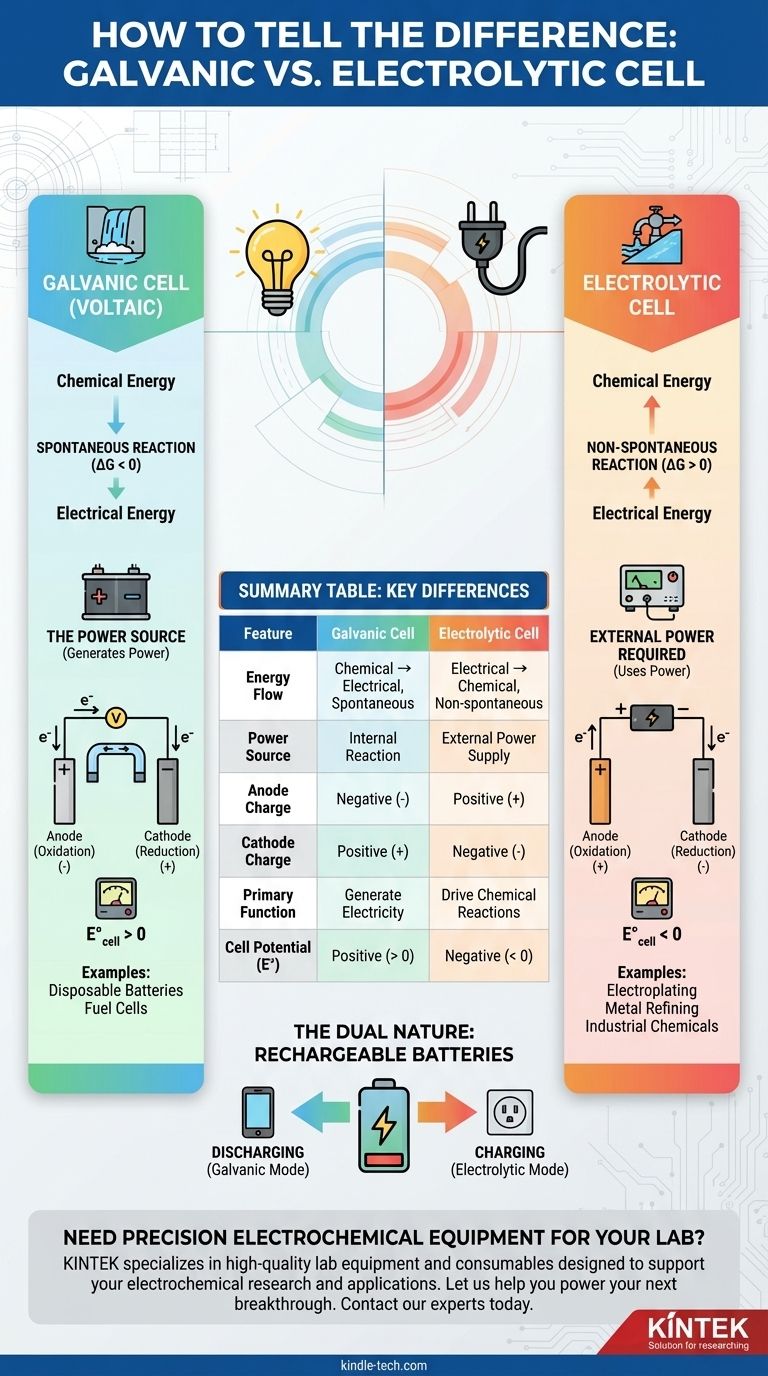
La différence fondamentale entre une pile galvanique et une cellule électrolytique réside dans le flux d'énergie. Une pile galvanique, également connue sous le nom de pile voltaïque, utilise une réaction chimique spontanée pour générer de l'énergie électrique. En revanche, une cellule électrolytique utilise de l'énergie électrique externe pour forcer une réaction chimique non spontanée à se produire.
Pensez-y de cette façon : Une pile galvanique est comme une cascade générant de l'énergie en coulant naturellement vers le bas. Une cellule électrolytique est comme une pompe utilisant une puissance externe pour faire remonter l'eau contre la gravité.

Le principe fondamental : Spontanéité et conversion d'énergie
Le comportement de toute cellule électrochimique est dicté par le fait que sa réaction interne se déroule d'elle-même ou nécessite une intervention externe.
Piles galvaniques : Libération d'énergie chimique
Une pile galvanique est définie par une réaction redox spontanée. Cela signifie que la réaction veut se produire d'elle-même, libérant de l'énergie au cours du processus.
Ce processus convertit l'énergie chimique stockée directement en énergie électrique. La pile elle-même est la source d'énergie.
Thermodynamiquement, cela correspond à une énergie de Gibbs négative (ΔG < 0) et à un potentiel de cellule positif (E°_cell > 0).
Cellules électrolytiques : Apport d'énergie électrique
Une cellule électrolytique implique une réaction non spontanée. Sans une poussée externe, cette réaction ne se produirait pas.
Elle nécessite une source d'énergie externe, comme une batterie ou une alimentation CC, pour faire avancer la réaction. Ce processus convertit l'énergie électrique en énergie chimique.
Cela correspond à une énergie de Gibbs positive (ΔG > 0) et à un potentiel de cellule négatif (E°_cell < 0). La tension externe doit être supérieure à ce potentiel négatif pour forcer la réaction.
Comment identifier chaque cellule : Indicateurs clés
Au-delà de la direction du flux d'énergie, vous pouvez distinguer les deux cellules en observant la polarité des électrodes et le circuit global.
La source d'énergie
C'est l'indicateur le plus simple. Si la cellule électrochimique est la batterie alimentant un appareil, il s'agit d'une pile galvanique.
Si la cellule est connectée à une batterie externe ou à une alimentation électrique, il s'agit d'une cellule électrolytique. La source externe fournit l'énergie nécessaire pour entraîner le processus.
Polarité des électrodes (un point de confusion courant)
Les définitions de l'anode et de la cathode sont constantes pour les deux types de cellules :
- Anode : L'électrode où se produit l'oxydation.
- Cathode : L'électrode où se produit la réduction.
Cependant, leur charge positive/négative (polarité) s'inverse :
Dans une pile galvanique, la réaction spontanée à l'anode libère des électrons, ce qui en fait la borne négative (-). La cathode, qui consomme des électrons, est la borne positive (+).
Dans une cellule électrolytique, la source d'énergie externe dicte la polarité. Elle retire les électrons de l'anode, ce qui en fait la borne positive (+), et pousse les électrons vers la cathode, ce qui en fait la borne négative (-).
Applications courantes et pièges
Le but de la cellule est son différenciateur le plus pratique. L'une crée de l'énergie, tandis que l'autre utilise l'énergie pour créer une substance ou un changement.
Le but d'une pile galvanique
La seule fonction d'une pile galvanique est d'agir comme source d'énergie électrique.
Les exemples courants incluent les piles jetables (AA, AAA), les piles à combustible et la fonction principale d'une batterie de voiture lorsqu'elle démarre le moteur.
Le but d'une cellule électrolytique
L'objectif d'une cellule électrolytique est de provoquer une transformation chimique utile qui ne se produirait pas autrement.
Les applications typiques incluent la galvanoplastie d'une fine couche de métal sur une surface, le raffinage de métaux comme le cuivre et l'aluminium, et la production de produits chimiques industriels comme le chlore gazeux.
La double nature des batteries rechargeables
Une batterie rechargeable est l'exemple parfait des deux types de cellules dans un seul appareil.
- Lors de la décharge (alimentant votre téléphone) : Elle agit comme une pile galvanique, avec une réaction spontanée générant de l'électricité.
- Lors de la charge (branchée au mur) : Elle agit comme une cellule électrolytique, l'énergie externe forçant la réaction inverse non spontanée à stocker de l'énergie.
Faire la bonne distinction pour votre objectif
Pour déterminer rapidement à quelle cellule vous avez affaire, concentrez-vous sur le flux d'énergie et l'objectif global du système.
- Si votre objectif principal est de générer de l'énergie : Vous avez affaire à une pile galvanique, où une réaction spontanée libère de l'énergie.
- Si votre objectif principal est de créer une substance ou d'inverser une réaction : Vous utilisez une cellule électrolytique, qui nécessite une source d'énergie externe pour entraîner un processus non spontané.
- Si vous analysez les signes des électrodes : N'oubliez pas que dans une pile galvanique, l'anode est négative, tandis que dans une cellule électrolytique, elle est positive, car la source d'énergie est soit interne, soit externe.
En fin de compte, comprendre si l'énergie est un produit ou une exigence est la clé pour distinguer ces deux cellules électrochimiques fondamentales.
Tableau récapitulatif :
| Caractéristique | Pile galvanique | Cellule électrolytique |
|---|---|---|
| Flux d'énergie | Chimique → Électrique (Spontané) | Électrique → Chimique (Non spontané) |
| Source d'énergie | Réaction interne | Alimentation électrique externe |
| Charge de l'anode | Négative (-) | Positive (+) |
| Charge de la cathode | Positive (+) | Négative (-) |
| Fonction principale | Générer de l'électricité | Provoquer des réactions chimiques (ex: galvanoplastie) |
| Potentiel de cellule (E°) | Positif (> 0) | Négatif (< 0) |
Besoin d'équipement électrochimique de précision pour votre laboratoire ?
Comprendre les nuances des piles galvaniques et des cellules électrolytiques est crucial pour les travaux de laboratoire avancés. Que vous développiez de nouvelles technologies de batteries, réalisiez de la galvanoplastie ou meniez des analyses de matériaux, disposer du bon équipement est essentiel.
KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité conçus pour soutenir votre recherche et vos applications électrochimiques. Nous fournissons des solutions fiables qui garantissent des résultats précis et améliorent l'efficacité de votre laboratoire.
Laissez-nous vous aider à propulser votre prochaine percée. Contactez nos experts dès aujourd'hui pour discuter de vos besoins spécifiques en laboratoire et découvrir comment nos produits peuvent favoriser votre succès.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Équipement de laboratoire de batterie Testeur complet de capacité et de batterie
- Papier Carbone Hydrophile TGPH060 pour Applications en Laboratoire de Batteries
Les gens demandent aussi
- Comment l'ajustement de l'espacement des électrodes peut-il optimiser l'électro-oxydation des eaux usées de farine de poisson ? Maximisez votre efficacité énergétique
- Quelle est la plage de température applicable pour la cellule électrolytique et comment la température est-elle contrôlée ? Obtenez des résultats électrochimiques précis
- Pourquoi les systèmes de polissage et de décapage électrolytiques de laboratoire sont-ils nécessaires ? Révéler la microstructure de l'acier inoxydable
- Quelle est la surface de réaction standard de la cellule électrolytique multifonctionnelle et comment est-elle scellée ? Assurez des résultats électrochimiques précis et reproductibles
- Quel est le processus de l'électrolyse dans une cellule électrolytique ? Un guide étape par étape pour forcer les réactions non spontanées
- Quelle est la plage de volume typique pour une seule chambre de la cellule électrolytique ? Un guide de dimensionnement pour votre laboratoire
- Comment un système de cellule électrolytique à trois électrodes garantit-il la précision ? Optimisation des tests de corrosion pour les composites d'alumine
- Comment la cellule électrolytique doit-elle être connectée aux équipements externes lors d'une expérience ? Un guide étape par étape




