Essentiellement, l'électrolyse est le processus d'utilisation de l'énergie électrique pour forcer une réaction chimique qui ne se produirait pas spontanément. Une source d'alimentation externe applique une tension aux deux électrodes immergées dans une solution conductrice ou un sel en fusion, appelée électrolyte. Cette énergie appliquée force les ions à migrer vers les électrodes de charge opposée, où ils subissent une décomposition par des réactions d'oxydation et de réduction.
Une cellule électrolytique est un moteur pour inverser les réactions chimiques. En appliquant une alimentation externe, elle force les électrons à circuler à l'encontre de leur tendance naturelle, obligeant les composés chimiques stables à se décomposer en leurs éléments constitutifs.

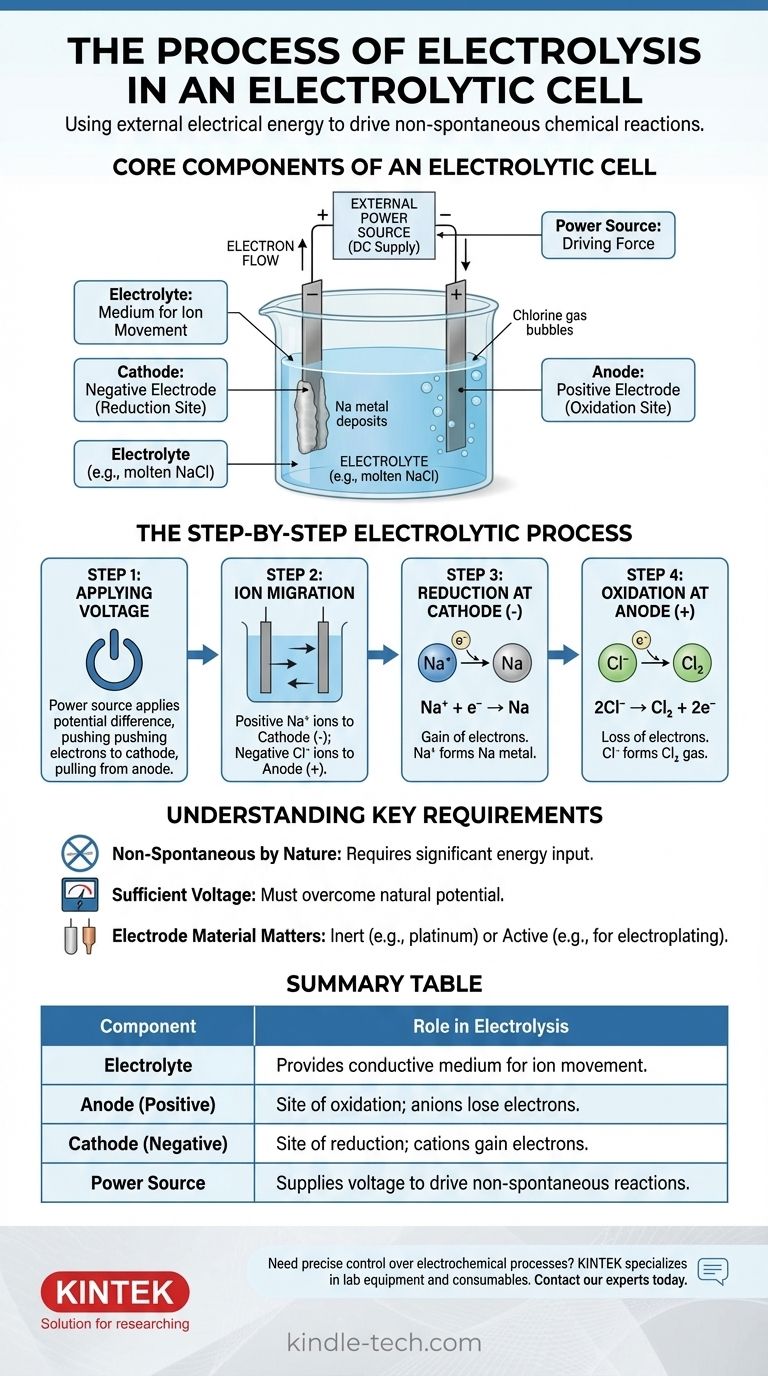
Les composants essentiels d'une cellule électrolytique
Pour comprendre le processus, vous devez d'abord comprendre la fonction de chaque partie. Le système est une interaction soigneusement orchestrée entre trois composants clés.
L'électrolyte : un milieu pour le mouvement des ions
L'électrolyte est une substance contenant des ions libres, ce qui la rend électriquement conductrice. Il s'agit généralement d'un composé ionique en fusion, comme le chlorure de sodium (NaCl), ou d'une solution aqueuse contenant des ions dissous.
Le seul but de l'électrolyte est de fournir un milieu par lequel les ions chargés peuvent voyager entre les électrodes.
Les électrodes : anode et cathode
Les électrodes sont des matériaux conducteurs (souvent des métaux ou du graphite) qui sont immergés dans l'électrolyte. Elles servent d'interface physique où le circuit électrique rencontre la solution chimique.
Dans une cellule électrolytique, la polarité est définie par la source d'alimentation externe :
- L'anode est l'électrode positive.
- La cathode est l'électrode négative.
La source d'alimentation externe : la force motrice
Il s'agit généralement d'une batterie ou d'une alimentation en courant continu. Son rôle est de créer une différence de potentiel aux bornes des électrodes, forçant les électrons à se déplacer dans une direction où ils ne le feraient pas spontanément.
Cette tension externe est la « pompe » qui entraîne l'ensemble de la réaction non spontanée, surmontant la stabilité chimique naturelle de l'électrolyte.
Le processus électrolytique étape par étape
Le processus se déroule selon une séquence précise une fois la source d'alimentation activée. Nous pouvons l'illustrer en utilisant l'exemple du chlorure de sodium (NaCl) en fusion.
Étape 1 : Application de la tension
Une tension externe est appliquée. La source d'alimentation pousse les électrons vers une électrode, la rendant chargée négativement (la cathode), et retire les électrons de l'autre, la rendant chargée positivement (l'anode).
Étape 2 : Migration des ions
Dans l'électrolyte de NaCl en fusion, le sodium existe sous forme d'ions positifs (cations, Na⁺) et le chlore sous forme d'ions négatifs (anions, Cl⁻).
Les contraires s'attirent : les cations Na⁺ positifs sont attirés vers la cathode négative, tandis que les anions Cl⁻ négatifs sont attirés vers l'anode positive.
Étape 3 : Réduction à la cathode (l'électrode négative)
Lorsque les cations Na⁺ atteignent la cathode chargée négativement, ils gagnent chacun un électron fourni par la source d'alimentation. Ce gain d'électrons est une réaction de réduction.
Les ions Na⁺ sont réduits pour former du sodium métallique neutre (Na), qui se dépose sur la cathode.
Étape 4 : Oxydation à l'anode (l'électrode positive)
Simultanément, lorsque les anions Cl⁻ atteignent l'anode chargée positivement, ils cèdent chacun un électron à l'électrode. Cette perte d'électrons est une réaction d'oxydation.
Les ions Cl⁻ sont oxydés pour former des atomes de chlore neutres, qui s'associent pour former du gaz chlore (Cl₂) qui s'échappe de l'anode. Les électrons libérés circulent à travers le circuit externe pour revenir à la source d'alimentation, complétant ainsi le circuit.
Comprendre les exigences clés
L'électrolyse est puissante mais fonctionne selon des contraintes spécifiques. Ignorer celles-ci peut entraîner des échecs expérimentaux ou une mauvaise interprétation des résultats.
Naturellement non spontanée
Le principe fondamental est que l'électrolyse force une réaction non spontanée. La décomposition du sel en sodium métallique et en gaz chlore, par exemple, nécessite un apport énergétique important. Sans la tension externe, rien ne se produirait.
La nécessité d'une tension suffisante
La source d'alimentation externe doit fournir une tension suffisamment élevée pour vaincre le potentiel naturel de la réaction chimique. Si la tension est trop faible, elle ne sera pas assez forte pour forcer la migration des ions et le transfert d'électrons, et la réaction ne se produira pas.
Le matériau de l'électrode est important
Pour une décomposition simple, on utilise des électrodes inertes (comme le platine ou le carbone). Ces matériaux facilitent le transfert d'électrons sans participer eux-mêmes à la réaction. Dans d'autres applications, comme la galvanoplastie, l'anode peut être une électrode « active » conçue pour être oxydée et dissoute dans l'électrolyte.
Application à des exemples courants
Les principes de l'électrolyse sont universels, mais les produits spécifiques dépendent entièrement de l'électrolyte utilisé.
- Si votre objectif est de produire des métaux purs : Utilisez un sel en fusion de ce métal comme électrolyte. Le métal pur sera réduit et déposé à la cathode, comme on le voit dans la production industrielle de sodium et d'aluminium.
- Si votre objectif est de décomposer l'eau : Utilisez de l'eau avec une petite quantité d'acide ou de sel pour améliorer la conductivité. Ce processus produira du gaz hydrogène (H₂) à la cathode et du gaz oxygène (O₂) à l'anode.
- Si votre objectif est de galvaniser un objet : L'objet à plaquer est désigné comme la cathode. Les ions métalliques de la solution électrolytique sont réduits à la surface de l'objet, formant un revêtement métallique mince et uniforme.
En contrôlant le flux d'électrons, nous pouvons contrôler et inverser directement les processus chimiques, une capacité fondamentale qui sous-tend une grande partie de l'industrie moderne.
Tableau récapitulatif :
| Composant | Rôle dans l'électrolyse |
|---|---|
| Électrolyte | Fournit un milieu conducteur pour le mouvement des ions (ex. : NaCl en fusion). |
| Anode (Positive) | Site de l'oxydation ; les anions perdent des électrons (ex. : Cl⁻ → gaz Cl₂). |
| Cathode (Négative) | Site de la réduction ; les cations gagnent des électrons (ex. : Na⁺ → métal Na). |
| Source d'alimentation | Fournit la tension nécessaire pour forcer les réactions non spontanées. |
Besoin d'un contrôle précis des processus électrochimiques ? KINTEK est spécialisée dans les équipements de laboratoire et les consommables pour l'électrolyse, la galvanoplastie et la synthèse de matériaux. Nos alimentations fiables, nos électrodes et nos solutions électrolytiques vous aident à obtenir des résultats constants, que vous décomposiez des composés, raffiniez des métaux ou revêtiez des surfaces. Contactez nos experts dès aujourd'hui pour discuter des besoins spécifiques de votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Cellule à flux personnalisable pour la réduction du CO2 pour la recherche sur le NRR, l'ORR et le CO2RR
- Boîtier de pile Li-Air pour applications de laboratoire de piles
Les gens demandent aussi
- Quel est le mécanisme de la cellule électrolytique double de Devanathan-Stachurski ? Exploration des tests précis de perméation de l'hydrogène
- Quel rôle joue une cellule électrolytique à chemise d'eau dans les mesures de corrosion électrochimique à température variable ?
- Comment les produits et le liquide résiduel doivent-ils être manipulés après une expérience ? Assurer la sécurité et la conformité du laboratoire
- Quelle est la précaution importante concernant la polarité des électrodes lors de la mise en place d'une cellule d'électrolyse ? Évitez les erreurs coûteuses et les expériences ratées
- Comment l'électrolyte est-il géré dans les cellules électrolytiques de type H pour des réactions spécifiques ? Obtenez un contrôle précis et une grande pureté
- Comment stocker la cellule électrolytique ? Assurer la longévité et la précision des données
- Quelles sont les préparations nécessaires pour l'électrolyte avant une expérience ? Un guide pour des résultats électrochimiques impeccables
- Quelles sont les procédures post-utilisation pour une cellule électrolytique à bain-marie à cinq orifices ? Assurer la sécurité et la longévité



















