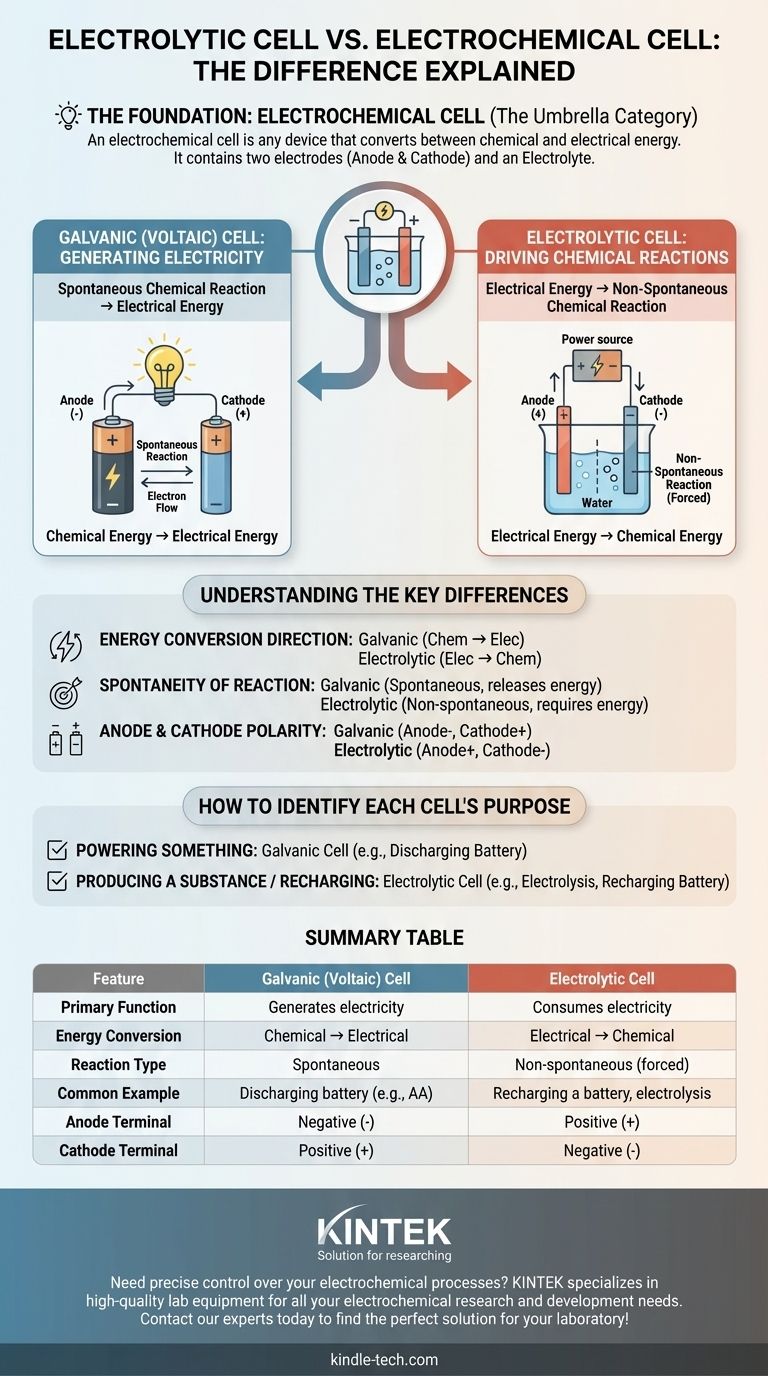
La principale source de confusion est qu'une cellule électrolytique n'est pas un concept distinct d'une cellule électrochimique – c'est l'un des deux principaux types de cellules électrochimiques. Une cellule électrochimique est la catégorie générale pour tout dispositif qui convertit l'énergie chimique en énergie électrique et vice-versa. La véritable distinction réside entre les cellules galvaniques (voltaïques), qui génèrent de l'électricité à partir de réactions chimiques, et les cellules électrolytiques, qui utilisent l'électricité pour provoquer des réactions chimiques.
Le terme cellule électrochimique est la catégorie générique. Les deux types spécifiques sous cette catégorie sont les cellules galvaniques (qui créent de l'électricité) et les cellules électrolytiques (qui consomment de l'électricité). Leur différence fondamentale est la direction de la conversion d'énergie.

Le fondement : Qu'est-ce qu'une cellule électrochimique ?
Composants essentiels
Une cellule électrochimique est tout dispositif contenant deux électrodes (une anode et une cathode) et un électrolyte. Ces composants travaillent ensemble pour faciliter le transfert d'électrons, soit en créant, soit en consommant un courant électrique.
L'objectif primordial
Le seul but d'une cellule électrochimique est de servir de pont entre l'énergie chimique et l'énergie électrique. La direction de cette conversion d'énergie détermine le type spécifique de cellule.
Les deux types fondamentaux de conversion
Cellules galvaniques (voltaïques) : Générer de l'électricité
Une cellule galvanique, également connue sous le nom de cellule voltaïque, exploite une réaction chimique spontanée pour produire de l'énergie électrique.
Pensez à une pile AA standard. Les matériaux chimiques qu'elle contient réagissent naturellement, libérant de l'énergie sous forme de courant électrique qui peut alimenter un appareil. C'est une cellule galvanique en action.
Cellules électrolytiques : Provoquer des réactions chimiques
Une cellule électrolytique fait exactement le contraire. Elle utilise une source externe d'énergie électrique (comme une alimentation électrique) pour forcer une réaction chimique non spontanée à se produire.
Un exemple courant est l'électrolyse, comme la séparation de l'eau en hydrogène et en oxygène. Cette réaction ne se produit pas d'elle-même ; elle nécessite un apport constant d'électricité, ce qui est la fonction de la cellule électrolytique. Recharger une batterie est un autre exemple de ce processus.
Comprendre les différences clés
Direction de la conversion d'énergie
C'est la distinction la plus critique. Une cellule galvanique convertit l'énergie chimique stockée en énergie électrique. Une cellule électrolytique convertit l'énergie électrique fournie en énergie chimique.
Spontanéité de la réaction
La réaction chimique dans une cellule galvanique est spontanée – elle se déroule naturellement et libère de l'énergie.
La réaction dans une cellule électrolytique est non spontanée – elle nécessite un apport constant d'énergie externe pour se produire.
Polarité de l'anode et de la cathode
C'est un point de confusion courant, mais il découle logiquement du flux d'énergie.
Dans une cellule galvanique (batterie en décharge), l'anode est la source d'électrons, ce qui en fait la borne négative, tandis que la cathode est la borne positive.
Dans une cellule électrolytique (batterie en charge), une source d'alimentation externe inverse le flux. L'anode est l'endroit où l'oxydation se produit toujours, mais elle est forcée d'être la borne positive, et la cathode est la borne négative.
Comment identifier le but de chaque cellule
Utilisez la fonction principale de la cellule comme guide pour distinguer facilement les deux types.
- Si l'objectif principal est d'alimenter quelque chose : Vous utilisez une cellule galvanique (voltaïque), car une réaction chimique spontanée produit de l'électricité.
- Si l'objectif principal est de produire une substance ou de recharger une batterie : Vous utilisez une cellule électrolytique, car l'électricité est consommée pour forcer une réaction chimique.
En fin de compte, les deux ne sont que les deux faces d'une même pièce électrochimique, définies par le fait qu'elles génèrent ou consomment de l'énergie électrique.
Tableau récapitulatif :
| Caractéristique | Cellule galvanique (voltaïque) | Cellule électrolytique |
|---|---|---|
| Fonction principale | Génère de l'électricité | Consomme de l'électricité |
| Conversion d'énergie | Chimique → Électrique | Électrique → Chimique |
| Type de réaction | Spontanée | Non spontanée (forcée) |
| Exemple courant | Batterie en décharge (ex. : AA) | Recharge d'une batterie, électrolyse |
| Borne de l'anode | Négative (-) | Positive (+) |
| Borne de la cathode | Positive (+) | Négative (-) |
Besoin d'un contrôle précis de vos processus électrochimiques ? KINTEK est spécialisé dans les équipements de laboratoire de haute qualité pour tous vos besoins en recherche et développement électrochimique. Que vous développiez de nouvelles technologies de batteries ou que vous synthétisiez des matériaux par électrolyse, nos instruments fiables garantissent des résultats précis et reproductibles. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Pourquoi une cellule à flux électrochimique personnalisée est-elle utilisée pour l'eCO2RR ? Atteindre des performances de qualité industrielle et une densité de courant
- Comment un système d'anodisation électrochimique contribue-t-il à des réseaux de nanotubes de TiO2 1D hautement ordonnés ?
- Quelles sont les étapes de préparation complètes à suivre avant d'utiliser une cellule électrolytique de corrosion à plaque plane ? Assurer des résultats précis et reproductibles
- Comment fonctionne une cellule électrolytique à diaphragme dans le béton de blindage contre les radiations ? Optimiser la densité avec de l'eau active
- Comment la cellule électrolytique doit-elle être connectée aux équipements externes lors d'une expérience ? Un guide étape par étape
- Quel rôle les systèmes de polissage et de gravure électrochimiques jouent-ils dans la révélation de la microstructure de l'acier duplex ? Révéler l'intégrité biphasée.
- Pourquoi utiliser une cellule à trois électrodes pour les tests de corrosion des liquides ioniques ? Assurer une précision de pointe dans les milieux acides
- Quels sont les avertissements clés pour le nettoyage de l'équipement ? Protégez votre laboratoire contre les dommages et les dangers



















