Oui, une électrode argent-chlorure d'argent (Ag/AgCl) est l'une des électrodes de référence les plus courantes et les plus fiables utilisées en électrochimie. Elle fournit un potentiel stable et constant qui agit comme un point de comparaison fixe, vous permettant de mesurer avec précision le potentiel d'une autre électrode (l'électrode de travail) au sein d'une cellule électrochimique. Cette stabilité la rend indispensable pour des applications allant de la mesure du pH à la voltammétrie cyclique.
La fonction principale d'une électrode de référence est de fournir une ligne de base de tension inchangée. L'électrode Ag/AgCl y parvient grâce à un équilibre chimique spécifique et stable, ce qui en fait un standard fiable et rentable en électrochimie moderne.

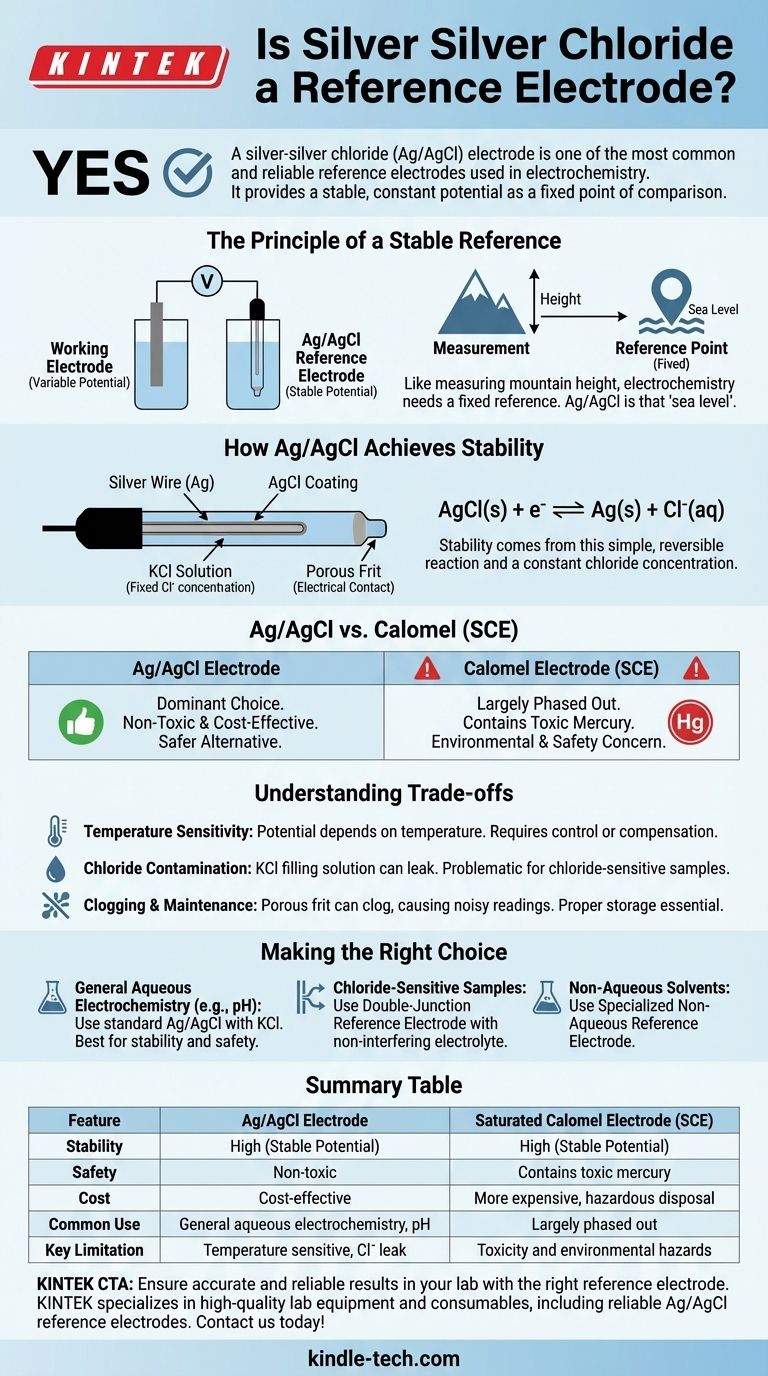
Le principe d'une référence stable
Pour comprendre pourquoi l'électrode Ag/AgCl est si efficace, nous devons d'abord comprendre ce qui fait une bonne référence. Une mesure électrochimique est toujours une comparaison de potentiel entre deux points.
Qu'est-ce qu'une électrode de référence ?
Une électrode de référence est une demi-cellule avec un potentiel d'électrode connu et stable. Son rôle est de rester constant, quelles que soient les modifications survenant dans l'autre moitié de la cellule (l'électrode de travail et la solution échantillon).
Pensez-y comme à la mesure de la hauteur d'une montagne. Vous avez besoin d'un point de référence fixe, comme le niveau de la mer, pour obtenir une mesure significative. En électrochimie, l'électrode de référence est le niveau de la mer.
Comment l'Ag/AgCl atteint la stabilité
La stabilité de l'électrode Ag/AgCl provient d'une réaction chimique simple et réversible. Elle se compose d'un fil d'argent recouvert d'une fine couche de chlorure d'argent (AgCl), le tout immergé dans une solution avec une concentration fixe d'ions chlorure (Cl⁻), généralement du chlorure de potassium (KCl).
Le potentiel est établi par l'équilibre entre le métal argent solide et son sel :
AgCl(s) + e⁻ ⇌ Ag(s) + Cl⁻(aq)
Parce que la concentration de la solution de chlorure à l'intérieur de l'électrode est maintenue constante, le potentiel de cette demi-réaction reste exceptionnellement stable.
Ag/AgCl vs. autres électrodes de référence
L'électrode Ag/AgCl n'est pas la seule option, mais ses avantages en ont fait un choix dominant par rapport aux anciens standards comme l'électrode au calomel saturée (ECS).
L'essor de l'Ag/AgCl
La principale raison de l'adoption généralisée de l'Ag/AgCl est sa sécurité et ses performances. Elle est relativement peu coûteuse à produire et, surtout, non toxique.
Le déclin de l'électrode au calomel (ECS)
L'électrode au calomel, qui utilise une pâte de mercure/chlorure mercureux, était autrefois un standard courant. Cependant, elle a été largement abandonnée dans de nombreux laboratoires.
La raison principale est la toxicité. Le mercure est un matériau dangereux, ce qui fait de l'utilisation, du stockage et de l'élimination des électrodes au calomel une préoccupation environnementale et de sécurité importante.
Comprendre les compromis
Bien que l'électrode Ag/AgCl soit un excellent choix polyvalent, elle n'est pas sans limites. Comprendre ces compromis est crucial pour des mesures précises.
Sensibilité à la température
Le potentiel d'une électrode Ag/AgCl dépend de la température. Pour un travail de haute précision, la température de la cellule doit être contrôlée et rapportée, ou une sonde de compensation de température doit être utilisée.
Contamination par le chlorure
L'électrode est remplie d'une solution concentrée de KCl. Une petite quantité de cette solution peut s'échapper de la fritte poreuse à l'extrémité de l'électrode et pénétrer dans votre échantillon. Si votre expérience est sensible aux ions chlorure, cela peut être une source d'erreur.
Colmatage et entretien
La fritte poreuse qui permet le contact électrique avec l'échantillon peut se boucher, entraînant des lectures de potentiel bruyantes ou dérivantes. Un stockage approprié (avec la pointe immergée dans sa solution de remplissage) et un entretien régulier sont essentiels pour une longue durée de vie et des résultats précis.
Faire le bon choix pour votre application
Le choix de l'électrode de référence et de la solution de remplissage appropriées est essentiel pour le succès expérimental. Votre choix dépend entièrement de la chimie de votre échantillon.
- Si vous effectuez une électrochimie aqueuse générale (comme la plupart des mesures de pH ou d'ions) : Une électrode Ag/AgCl avec une solution de remplissage de KCl standard est presque toujours le meilleur choix en raison de sa stabilité et de sa sécurité.
- Si votre échantillon réagit avec ou est sensible aux ions chlorure : Vous devez utiliser une électrode de référence à "double jonction", où une chambre externe avec un électrolyte non interférant (comme le nitrate de potassium) isole l'élément interne Ag/AgCl de votre échantillon.
- Si vous travaillez dans des solvants non aqueux : Vous aurez besoin d'une électrode de référence non aqueuse spécialisée, car les électrodes aqueuses standard ne fonctionneront pas correctement et contamineront votre solvant.
En fin de compte, choisir la bonne électrode de référence consiste à s'assurer qu'elle reste un observateur inerte et stable de la réaction chimique que vous souhaitez étudier.
Tableau récapitulatif :
| Caractéristique | Électrode Ag/AgCl | Électrode au calomel saturée (ECS) |
|---|---|---|
| Stabilité | Élevée (potentiel stable) | Élevée (potentiel stable) |
| Sécurité | Non toxique | Contient du mercure toxique |
| Coût | Rentable | Plus chère, élimination dangereuse |
| Utilisation courante | Électrochimie aqueuse générale, mesure du pH | Largement abandonnée en raison de problèmes de sécurité |
| Principale limitation | Sensible à la température, risque de contamination par le chlorure | Toxicité et dangers environnementaux |
Assurez des résultats précis et fiables dans votre laboratoire avec la bonne électrode de référence. KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, y compris les électrodes de référence Ag/AgCl fiables adaptées à vos applications électrochimiques. Nos experts peuvent vous aider à choisir l'électrode parfaite pour maintenir la stabilité et éviter la contamination dans vos expériences. Contactez-nous dès aujourd'hui pour améliorer la précision et la sécurité de votre laboratoire !
Guide Visuel
Produits associés
- Électrode de référence au calomel, chlorure d'argent, sulfate de mercure pour usage en laboratoire
- Électrode électrochimique à disque métallique
- Électrode à disque d'or
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode électrochimique en graphite, tige et plaque de graphite
Les gens demandent aussi
- Quelle électrode est utilisée comme référence ? Un guide pour des mesures électrochimiques précises
- Quelles sont les précautions générales à prendre lors de l'utilisation d'une électrode de référence ? Assurer des potentiels stables pour des données précises
- Pourquoi une électrode à calomel saturée (ECS) est-elle utilisée comme électrode de référence dans la recherche sur les piles à combustible microbiennes ?
- Quels sont les quatre principaux types de capteurs ? Un guide sur la source d'alimentation et le type de signal
- Quelles sont les caractéristiques d'une électrode au calomel saturée pour les solutions neutres ? Comprendre sa stabilité et ses limites.

















