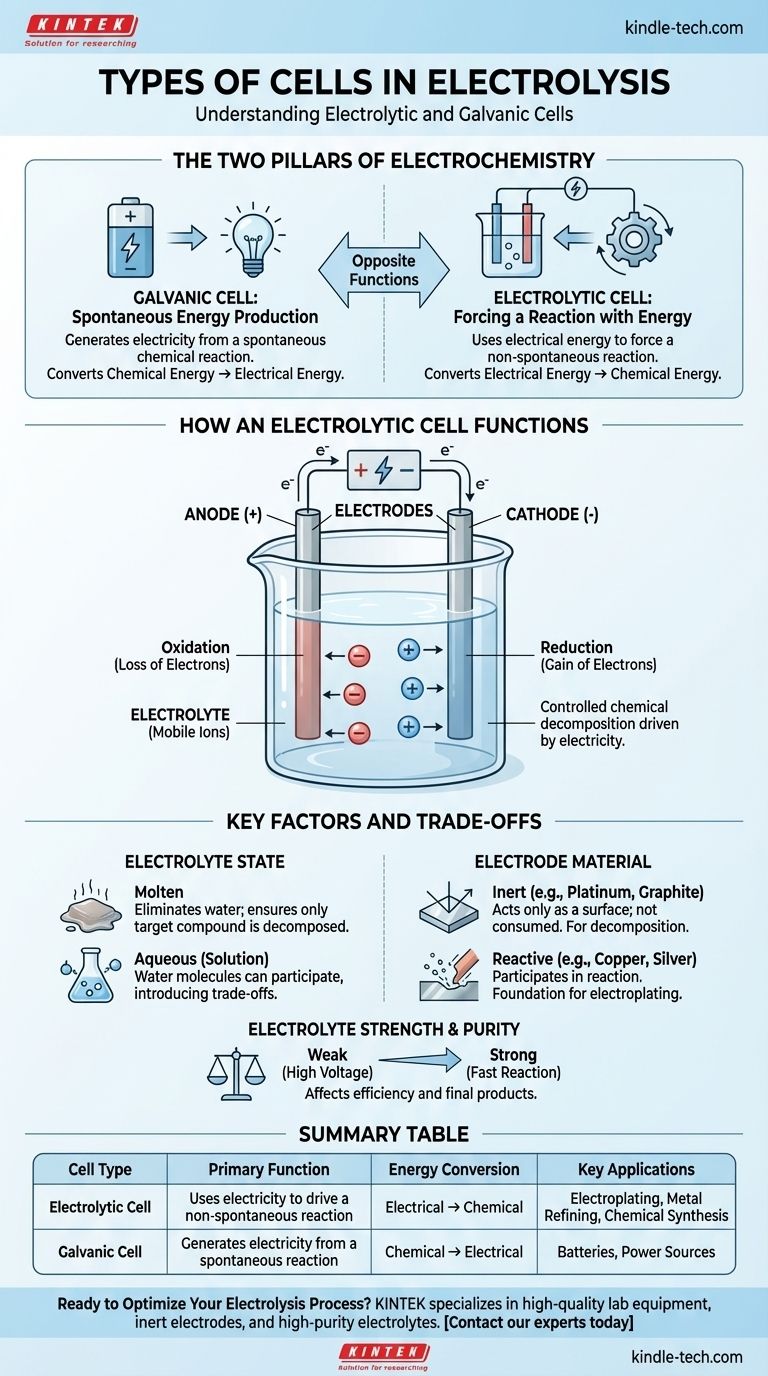
Fondamentalement, l'électrolyse se produit au sein d'un type spécifique de cellule électrochimique connu sous le nom de cellule électrolytique. Cette cellule est l'un des deux types fondamentaux de cellules électrochimiques, l'autre étant la cellule galvanique. Une cellule électrolytique utilise de l'énergie électrique pour forcer une réaction chimique non spontanée, tandis qu'une cellule galvanique fait le contraire, générant de l'électricité à partir d'une réaction chimique spontanée.
La distinction essentielle est l'objectif. Une cellule galvanique (comme une batterie) produit de l'électricité à partir d'une réaction chimique. Une cellule électrolytique utilise de l'électricité pour mener une réaction chimique qui ne se produirait pas d'elle-même.

Les Deux Piliers de l'Électrochimie
Pour comprendre la cellule utilisée pour l'électrolyse, vous devez d'abord comprendre son homologue. Les deux types de cellules sont fondamentaux pour l'électrochimie, mais ils servent des fonctions opposées.
La Cellule Galvanique : Production d'Énergie Spontanée
Une cellule galvanique est ce que nous connaissons communément sous le nom de batterie. Elle exploite une réaction chimique spontanée qui veut naturellement se produire.
À mesure que cette réaction progresse, elle libère de l'énergie sous forme de courant électrique. Elle convertit directement l'énergie chimique stockée en énergie électrique.
La Cellule Électrolytique : Forcer une Réaction avec de l'Énergie
Une cellule électrolytique est le moteur de l'électrolyse. Elle est conçue pour provoquer une réaction chimique non spontanée en fournissant une énergie externe.
Vous appliquez un courant électrique provenant d'une source extérieure (comme une alimentation électrique) à la cellule. Cela force la décomposition d'une substance, convertissant efficacement l'énergie électrique en énergie chimique en créant de nouvelles substances.
Fonctionnement d'une Cellule Électrolytique
Le processus d'électrolyse est une décomposition chimique contrôlée par l'électricité. Cela nécessite quelques composants clés fonctionnant de concert.
Les Composants de Base
Une cellule électrolytique se compose de deux électrodes (une anode positive et une cathode négative) immergées dans un électrolyte. Une source d'alimentation externe est connectée à ces électrodes, créant un circuit.
Le Rôle de l'Électrolyte
L'électrolyte est la substance qui sera décomposée. Il s'agit généralement d'un composé ionique, soit à l'état fondu, soit dissous dans une solution (aqueuse).
Cette substance doit contenir des ions mobiles qui sont libres de se déplacer et de transporter une charge. Les électrolytes sont généralement des solutions d'acides, de bases ou de sels.
La Fonction des Électrodes
Les électrodes sont les conducteurs par lesquels l'électricité entre et sort de l'électrolyte.
- Anode : L'électrode positive. Elle attire les ions négatifs (anions), où se produit l'oxydation (perte d'électrons).
- Cathode : L'électrode négative. Elle attire les ions positifs (cations), où se produit la réduction (gain d'électrons).
La source d'alimentation externe est ce qui maintient cette séparation de charge et pilote l'ensemble du processus.
Comprendre les Facteurs Clés et les Compromis
Le résultat de l'électrolyse n'est pas automatique. Les produits spécifiques que vous créez dépendent entièrement des matériaux et des conditions que vous choisissez.
État de l'Électrolyte : Fondu vs. Aqueux
L'état de l'électrolyte est une décision critique. Si vous utilisez une solution aqueuse (dissoute dans l'eau), les molécules d'eau elles-mêmes peuvent participer à la réaction.
Cela introduit un compromis, car l'électricité peut décomposer l'eau au lieu du composé dissous, selon la réaction la plus facile à mener. L'utilisation d'un électrolyte fondu élimine l'eau de l'équation, garantissant que seul le composé cible est décomposé.
Matériau de l'Électrode : Inerte vs. Réactif
Les électrodes peuvent être des participants passifs ou des acteurs actifs dans la réaction.
- Électrodes Inertes (ex. : Platine, Graphite) : Elles agissent uniquement comme une surface pour que la réaction se produise. Elles ne sont pas consommées et sont utilisées lorsque vous souhaitez décomposer l'électrolyte lui-même, comme séparer l'eau en hydrogène et en oxygène.
- Électrodes Réactives (ex. : Cuivre, Argent) : Elles peuvent se dissoudre ou participer à la réaction chimique. C'est le principe de la galvanoplastie (électrodéposition), où l'anode se dissout et ses ions métalliques sont déposés sur l'objet à la cathode.
Force et Pureté de l'Électrolyte
L'efficacité de l'électrolyse est également influencée par l'électrolyte. Les électrolytes forts, qui se dissocient complètement en ions, conduisent bien l'électricité et permettent une réaction plus rapide.
Les électrolytes faibles nécessitent plus d'énergie (une tension plus élevée) pour initier et maintenir la réaction. La présence d'autres agents oxydants ou réducteurs dans l'électrolyte peut également modifier les produits finaux.
Application à Votre Objectif
Comprendre la fonction d'une cellule électrolytique vous permet de contrôler les réactions chimiques à des fins industrielles et scientifiques spécifiques.
- Si votre objectif principal est de produire une substance pure : Choisissez une électrode inerte et un électrolyte de haute pureté (fondu ou aqueux) pour garantir la décomposition du composé cible, comme lors de la production d'aluminium à partir de minerai de bauxite.
- Si votre objectif principal est de revêtir ou de purifier un métal : Utilisez une anode réactive constituée du matériau de revêtement et un électrolyte contenant des ions de ce même métal. C'est le fondement de la galvanoplastie et de l'électroraffinage.
- Si votre objectif principal est de générer de l'électricité : Vous avez besoin d'une cellule galvanique, et non d'une cellule électrolytique, car sa fonction est de libérer de l'énergie à partir d'une réaction spontanée.
En fin de compte, l'électrolyse fournit une méthode puissante pour utiliser l'énergie électrique afin de contrôler précisément et de mener des changements chimiques.
Tableau Récapitulatif :
| Type de Cellule | Fonction Principale | Conversion d'Énergie | Applications Clés |
|---|---|---|---|
| Cellule Électrolytique | Utilise l'électricité pour mener une réaction non spontanée | Électrique → Chimique | Galvanoplastie, Affinage des Métaux, Synthèse Chimique |
| Cellule Galvanique | Génère de l'électricité à partir d'une réaction spontanée | Chimique → Électrique | Piles, Sources d'Alimentation |
Prêt à Optimiser Votre Processus d'Électrolyse ?
Comprendre le bon type de cellule et les bons composants est crucial pour une galvanoplastie, un affinage des métaux ou une synthèse chimique efficaces. KINTEK se spécialise dans la fourniture d'équipements de laboratoire et de consommables de haute qualité, y compris des électrodes inertes et des électrolytes de haute pureté, pour garantir que vos processus électrolytiques soient précis et efficaces.
Contactez nos experts dès aujourd'hui pour discuter de votre application spécifique et découvrir comment nos solutions peuvent améliorer les capacités et les résultats de votre laboratoire.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Quels sont les avantages de l'utilisation d'une cellule électrolytique à circulation ? Accélérez la dégradation des polluants grâce au contrôle actif du flux
- Quelle est la procédure d'arrêt correcte après une expérience ? Un guide étape par étape pour une désactivation sûre
- Comment un système de protection à l'argon de haute pureté contribue-t-il au processus de synthèse électrochimique de sels fondus ? Assurer la pureté de phase des matériaux
- Quelle est la fonction des copeaux de titane métallique utilisés comme épurateurs dans les cellules de réaction d'expériences de corrosion ? Assurer la pureté des données
- Quels sont les avantages techniques de l'utilisation des réacteurs PEM pour la biomasse gazeuse ? Amélioration de la stabilité et de la pureté
- Quelles sont les fonctions principales d'une cellule d'électroextraction spécialisée ? Optimiser la récupération et la pureté de l'or
- Qu'est-ce qu'une cellule électrolytique à double enveloppe à bain-marie ? Obtenez un contrôle précis de la température pour votre électrolyse
- Pourquoi un système de cellule électrochimique à trois électrodes à température constante est-il utilisé dans la déposition électrolytique du manganèse ?



















