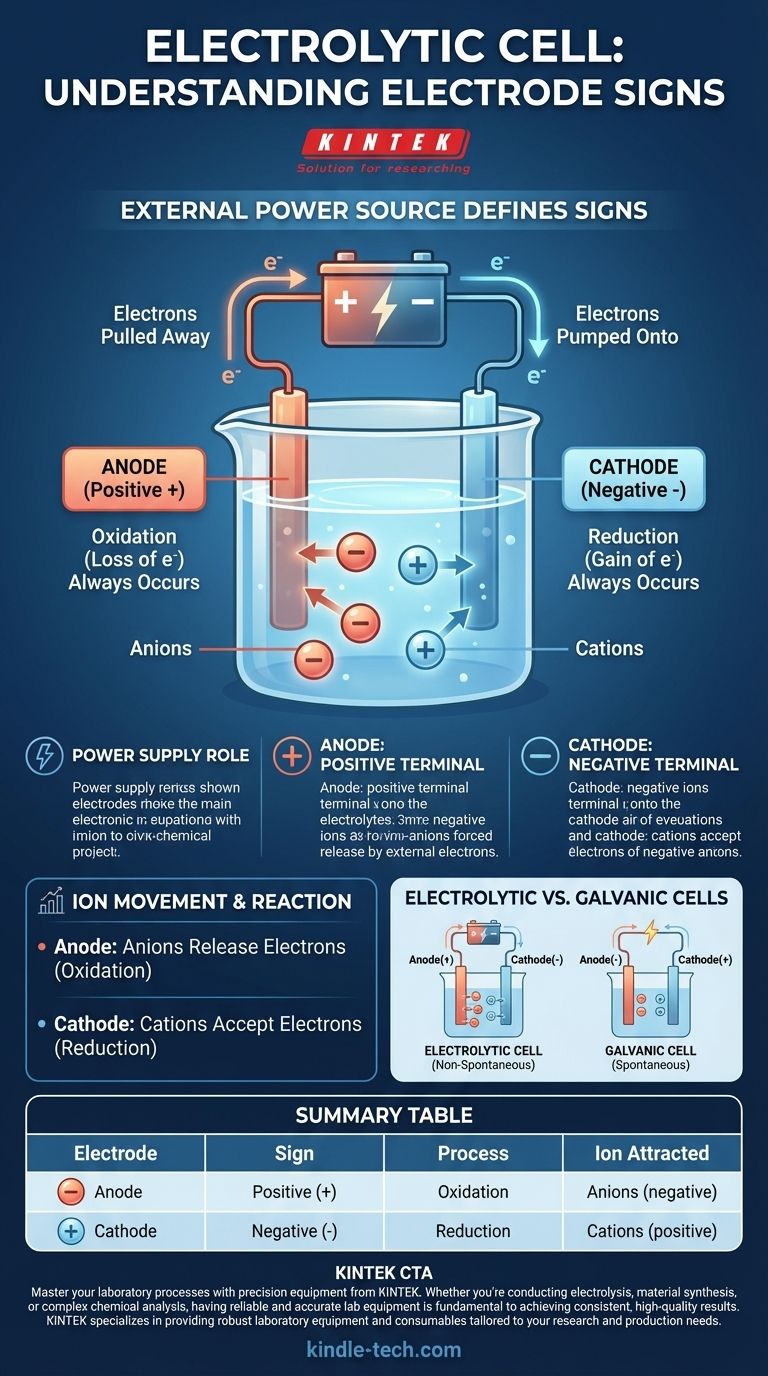
Dans une cellule électrolytique, la convention de signe est définie par la source d'alimentation externe. L'anode se voit attribuer un signe positif (+), et la cathode se voit attribuer un signe négatif (-). Ceci est dû au fait qu'une tension externe est appliquée pour entraîner une réaction chimique qui ne se produirait pas spontanément.
La clé pour comprendre une cellule électrolytique est de reconnaître qu'il ne s'agit pas d'un système autonome. Les signes de ses électrodes sont entièrement dictés par l'alimentation électrique externe à laquelle elle est connectée, forçant un changement chimique non spontané à se produire.

Pourquoi une source d'alimentation externe définit les signes
Une cellule électrolytique utilise l'énergie électrique pour créer de l'énergie chimique. Ce processus, connu sous le nom d'électrolyse, nécessite une force extérieure – une batterie ou une alimentation CC – pour initier et maintenir la réaction.
Le rôle de l'alimentation électrique
L'alimentation électrique agit comme une "pompe à électrons". Elle tire les électrons d'une électrode et les pousse vers l'autre, créant un déséquilibre de charge qui force les ions de la solution électrolytique à réagir.
L'anode est connectée à la borne positive
La borne positive de l'alimentation électrique externe est connectée à l'anode. Cette borne retire activement les électrons de l'anode, la laissant avec une charge nette positive.
La cathode est connectée à la borne négative
Inversement, la borne négative de l'alimentation électrique est connectée à la cathode. Cette borne pompe activement les électrons sur la cathode, lui donnant un excès d'électrons et une charge nette négative.
Comment le mouvement des ions crée la réaction
Les charges forcées sur les électrodes sont ce qui attire les ions dissous dans l'électrolyte, les obligeant à se déplacer et à réagir. Les définitions fondamentales de l'oxydation et de la réduction restent constantes.
Anode : Le site de l'oxydation (toujours)
Quel que soit le type de cellule, l'oxydation (la perte d'électrons) se produit toujours à l'anode. Dans une cellule électrolytique, les ions chargés négativement (anions) sont attirés par l'anode positive, où ils libèrent leurs électrons en excès et sont oxydés.
Cathode : Le site de la réduction (toujours)
De même, la réduction (le gain d'électrons) se produit toujours à la cathode. Les ions chargés positivement (cations) dans la solution sont attirés par la cathode négative, où ils acceptent les électrons en excès et sont réduits.
Une distinction critique : Cellules électrolytiques vs. galvaniques
Une source principale de confusion survient lors de la comparaison des cellules électrolytiques avec les cellules galvaniques (ou voltaïques), comme une batterie standard. Leurs conventions de signe sont opposées pour une raison très spécifique.
Réactions spontanées vs. non spontanées
Une cellule galvanique fonctionne sur une réaction chimique spontanée qui produit de l'énergie électrique. Ici, l'anode est la source naturelle d'électrons, ce qui la rend négative, et la cathode est l'endroit où ils sont consommés, ce qui la rend positive.
Une cellule électrolytique exécute une réaction non spontanée qui consomme de l'énergie électrique. La source d'alimentation externe inverse la polarité naturelle pour forcer la réaction à se produire.
La constante universelle
Malgré la différence de signes, les processus fondamentaux sont les mêmes dans les deux types de cellules :
- L'anode est toujours le site de l'oxydation.
- La cathode est toujours le site de la réduction.
Comment se souvenir des signes
Utilisez ces principes pour garder les conventions claires en fonction de votre objectif.
- Si votre objectif principal est d'identifier les bornes : N'oubliez pas que dans une cellule électrolytique, les signes correspondent à l'alimentation électrique externe : l'anode est positive et la cathode est négative.
- Si votre objectif principal est de suivre les ions : Suivez la règle simple des charges opposées : les anions négatifs se déplacent vers l'anode positive, et les cations positifs se déplacent vers la cathode négative.
- Si votre objectif principal est de distinguer les types de cellules : Associez "électrolytique" à une source d'alimentation externe qui force une charge positive sur l'anode et une charge négative sur la cathode pour entraîner la réaction.
En fin de compte, les signes d'une cellule électrolytique sont une conséquence directe d'une source d'alimentation externe qui annule le flux naturel d'une réaction chimique.
Tableau récapitulatif :
| Électrode | Signe | Processus | Ion attiré |
|---|---|---|---|
| Anode | Positive (+) | Oxydation | Anions (négatifs) |
| Cathode | Négative (-) | Réduction | Cations (positifs) |
Maîtrisez vos processus de laboratoire avec des équipements de précision de KINTEK.
Que vous meniez une électrolyse, une synthèse de matériaux ou une analyse chimique complexe, disposer d'un équipement de laboratoire fiable et précis est fondamental pour obtenir des résultats cohérents et de haute qualité. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire robustes et de consommables adaptés à vos besoins de recherche et de production.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont nos solutions peuvent stimuler vos innovations et améliorer l'efficacité de vos flux de travail en laboratoire.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrolytique électrochimique à bain-marie double couche
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrochimique électrolytique à bain-marie optique
Les gens demandent aussi
- Quelles sont les spécifications standard pour le volume et les ouvertures de la cellule électrolytique Raman in situ ? Maîtrisez la conception pour une analyse précise
- Comment les fonctions de la cathode et de l'anode sont-elles définies dans une cellule électrolytique ? Guide expert de l'électrolyse
- Quelle est la procédure correcte pour installer les électrodes dans la cellule électrolytique ? Assurez des expériences précises et sûres
- Quel est le rôle d'un réacteur en verre dans l'électrolyse de l'eau alcaline ? Assurer la sécurité et la précision visuelle
- Quels sont les avantages de l'utilisation de l'acier inoxydable résistant à la corrosion pour une cellule de réaction ? Assurer l'intégrité des données in-situ
- Quelle est l'application de la méthode d'électrodéposition ? De la protection de surface à la fabrication à l'échelle nanométrique
- Quel rôle les cellules de blocage personnalisées en acier inoxydable jouent-elles dans l'évaluation des électrolytes solides ? Optimisez les tests de batteries
- Quels sont les avantages de l'utilisation d'une cellule électrolytique transparente pour l'OCP ? Surveillance visuelle de la corrosion en temps réel



















