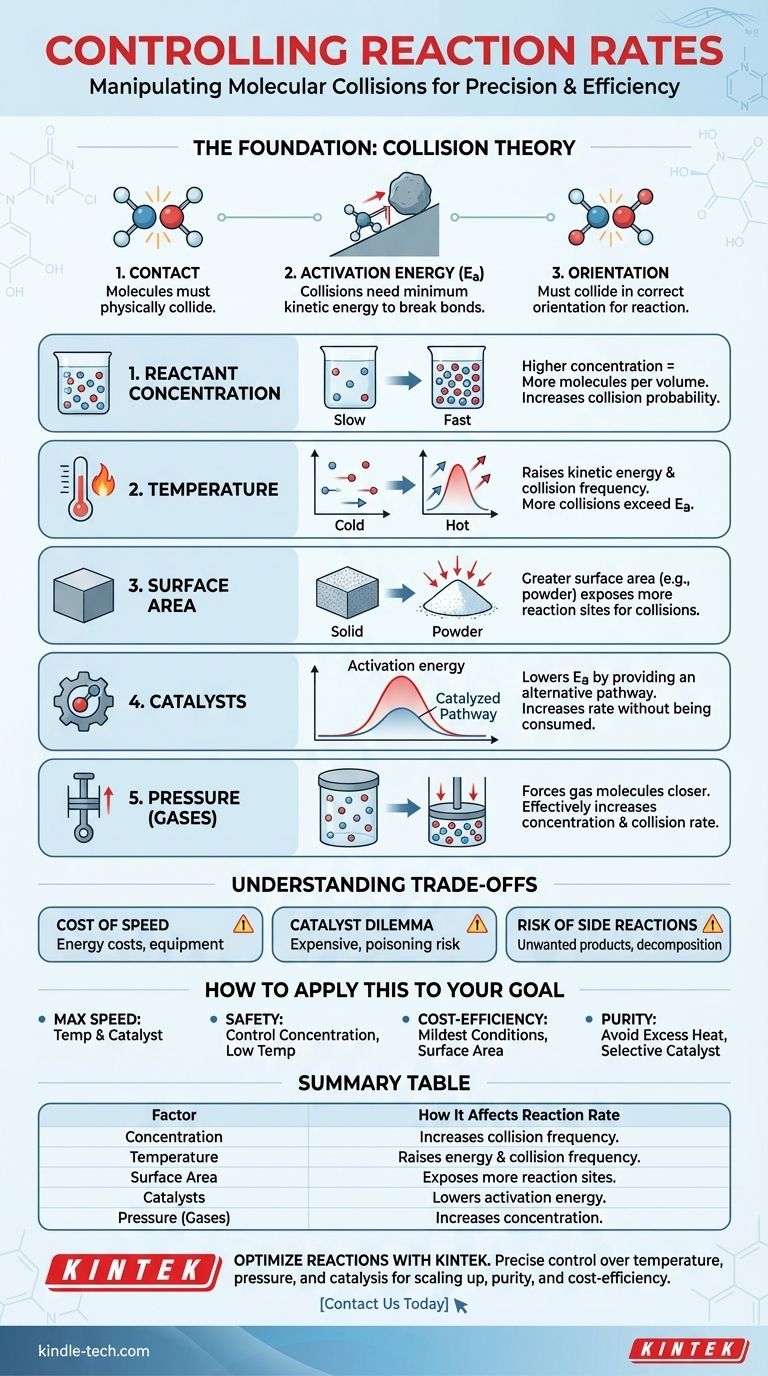
Essentiellement, cinq facteurs principaux contrôlent la vitesse d'une réaction chimique : la concentration des réactifs, la température, l'état physique et la surface des réactifs, la présence d'un catalyseur et, pour les gaz, la pression. Chacun de ces facteurs influence la fréquence et l'énergie des collisions moléculaires, qui est le moteur fondamental de tout changement chimique.
La vitesse de toute réaction chimique est déterminée par la fréquence à laquelle les molécules réactives entrent en collision avec la bonne orientation et avec suffisamment d'énergie pour surmonter la barrière d'énergie d'activation de la réaction. Tout ce qui contrôle les vitesses de réaction n'est qu'un levier pour manipuler la fréquence et l'efficacité de ces collisions.

Le fondement : La théorie des collisions
Pour contrôler une réaction, vous devez d'abord comprendre que les réactions ne sont pas des événements instantanés. Elles sont le résultat d'interactions physiques entre les molécules. Ceci est expliqué par la théorie des collisions.
Le besoin de contact
Pour qu'une réaction se produise, les molécules réactives doivent entrer physiquement en collision les unes avec les autres. Si elles se trouvent dans des récipients séparés, aucune réaction ne peut avoir lieu. La vitesse de la réaction est directement liée à la fréquence de ces collisions.
L'exigence énergétique (Énergie d'activation)
Une simple collision ne suffit pas. Les molécules qui entrent en collision doivent posséder une certaine quantité minimale d'énergie cinétique, connue sous le nom d'énergie d'activation (Ea). Cette énergie est nécessaire pour rompre les liaisons chimiques existantes afin que de nouvelles puissent se former.
Considérez l'énergie d'activation comme une colline sur laquelle vous devez pousser un rocher. Un léger coup de pouce (une collision de faible énergie) ne fera rien. Vous devez fournir suffisamment de poussée (énergie suffisante) pour atteindre le sommet de la colline, après quoi il peut dévaler l'autre côté et libérer de l'énergie.
Le facteur d'orientation
Enfin, les molécules doivent entrer en collision dans une orientation spécifique qui permet aux liaisons correctes de se rompre et aux nouvelles de se former. Une collision aléatoire sous un mauvais angle, même si elle est suffisamment énergétique, n'entraînera pas de réaction.
Les cinq leviers pour contrôler la vitesse de réaction
Comprendre la théorie des collisions vous donne cinq leviers distincts à actionner pour accélérer ou ralentir une réaction. Chacun fonctionne en influençant la fréquence des collisions, l'énergie des collisions ou la barrière d'énergie d'activation elle-même.
1. Concentration des réactifs
Augmenter la concentration des réactifs signifie qu'il y a plus de molécules entassées dans un volume donné. Cela augmente directement la probabilité qu'elles entrent en collision, augmentant ainsi la vitesse de réaction.
2. Température
Augmenter la température a un double effet puissant. Premièrement, elle augmente l'énergie cinétique des molécules, les faisant bouger plus vite et entrer en collision plus fréquemment. Deuxièmement, et c'est le plus important, elle augmente l'énergie de ces collisions, ce qui signifie qu'un pourcentage plus élevé d'entre elles aura suffisamment d'énergie pour franchir la barrière d'énergie d'activation.
3. État physique et surface
Ceci est le plus pertinent pour les réactions impliquant différentes phases, comme un solide réagissant avec un liquide (réactions hétérogènes). Un bloc solide a une surface limitée où les collisions peuvent se produire. Moudre ce même bloc en une poudre fine augmente considérablement sa surface, exposant plus de molécules et créant beaucoup plus de sites pour que les réactions se produisent.
4. Catalyseurs
Un catalyseur augmente la vitesse de réaction sans être consommé dans le processus. Il le fait en fournissant une voie de réaction alternative avec une énergie d'activation plus faible.
Pour revenir à notre analogie, un catalyseur est comme construire un tunnel à travers la colline. Vous n'avez plus besoin de pousser le rocher jusqu'au sommet ; vous pouvez le faire passer de l'autre côté avec beaucoup moins d'effort. Cela permet à plus de molécules de réagir avec succès, même à des températures plus basses.
5. Pression (pour les réactions gazeuses)
Pour les réactions impliquant des gaz, l'augmentation de la pression force les molécules de gaz à se rapprocher. C'est effectivement la même chose que d'augmenter leur concentration, ce qui entraîne des collisions plus fréquentes et une vitesse de réaction plus rapide.
Comprendre les compromis
La manipulation des vitesses de réaction n'est pas sans conséquences. Un conseiller technique efficace doit tenir compte des implications pratiques et économiques de chaque choix.
Le coût de la vitesse
L'augmentation de la température et de la pression nécessite de l'énergie, ce qui coûte de l'argent. Cela peut également exiger des réacteurs spécialisés à haute pression qui sont coûteux à construire et à entretenir, introduisant des considérations de sécurité.
Le dilemme du catalyseur
Les catalyseurs peuvent être très efficaces mais sont souvent coûteux (par exemple, l'utilisation de métaux précieux comme le platine ou le palladium). Ils peuvent également être très spécifiques à une réaction et peuvent être rendus inactifs par des impuretés, un processus connu sous le nom d'« empoisonnement du catalyseur ».
Risque de réactions secondaires indésirables
Forcer une réaction trop fort, surtout avec une chaleur excessive, peut entraîner des résultats indésirables. Les réactifs ou les produits peuvent commencer à se décomposer, ou l'énergie accrue peut permettre des réactions secondaires indésirables, réduisant la pureté et le rendement de votre produit souhaité.
Comment appliquer cela à votre objectif
Votre stratégie pour contrôler une réaction dépend entièrement de ce que vous essayez d'accomplir.
- Si votre objectif principal est la vitesse maximale : Les leviers les plus puissants sont l'augmentation de la température et l'utilisation d'un catalyseur efficace, car les deux augmentent considérablement le nombre de collisions réussies et énergétiques.
- Si votre objectif principal est la sécurité et le contrôle : La gestion attentive de la concentration des réactifs (par exemple, en ajoutant lentement un réactif à un autre) et l'utilisation de la température efficace la plus basse sont les meilleures approches.
- Si votre objectif principal est la rentabilité : Optimisez pour les conditions les plus douces possibles. Cela peut impliquer de trouver un catalyseur abordable ou d'augmenter la surface pour éviter les coûts énergétiques élevés de la chaleur et de la pression extrêmes.
- Si votre objectif principal est la pureté du produit : Évitez les températures excessivement élevées qui pourraient provoquer une décomposition ou des réactions secondaires, et assurez-vous que votre catalyseur est hautement sélectif pour la réaction souhaitée.
En fin de compte, contrôler une réaction chimique est l'art de gérer précisément les conditions qui régissent les collisions moléculaires.
Tableau récapitulatif :
| Facteur | Comment cela affecte la vitesse de réaction |
|---|---|
| Concentration | Une concentration plus élevée augmente la fréquence des collisions entre les molécules réactives. |
| Température | Augmente l'énergie moléculaire et la fréquence des collisions ; plus de collisions dépassent l'énergie d'activation. |
| Surface | Une plus grande surface (par exemple, solide en poudre) expose plus de sites de réaction pour les collisions. |
| Catalyseurs | Abaisse l'énergie d'activation en fournissant une voie de réaction alternative. |
| Pression (Gaz) | Augmente la concentration des molécules de gaz, entraînant des collisions plus fréquentes. |
Optimisez vos réactions chimiques avec l'équipement de précision de KINTEK. Que vous augmentiez la production, assuriez la pureté du produit ou maximisiez l'efficacité des coûts, nos équipements de laboratoire et consommables sont conçus pour vous donner un contrôle précis des conditions de réaction. Laissez nos experts vous aider à choisir les bons outils pour gérer la température, la pression et la catalyse pour vos besoins spécifiques. Contactez-nous dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir le succès de votre laboratoire !
Guide Visuel
Produits associés
- Mini réacteur autoclave haute pression SS pour utilisation en laboratoire
- Réacteur Autoclave Haute Pression en Acier Inoxydable pour Laboratoire
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Presse hydraulique chauffante automatique avec plaques chauffantes pour presse à chaud de laboratoire 25T 30T 50T
Les gens demandent aussi
- Quel rôle joue un réacteur revêtu de téflon dans la préparation d'hydrogels de graphène ? Assurer la pureté et l'efficacité du dopage
- Quelles conditions clés un réacteur SHS haute pression fournit-il ? Synthèse de composites d'acier haute performance
- Pourquoi des réacteurs à haute pression sont-ils nécessaires pour la production de furfural ? Assurer des rendements élevés et une conversion efficace de la biomasse
- Comment la température hydrothermale affecte-t-elle le ZrO2 ? Optimisation de la structure cristalline et de l'uniformité des particules
- Comment un réacteur à haute pression contribue-t-il à la synthèse de l'hydroxyapatite mésoporeuse ? Ingénierie Hydrothermale de Précision
- Comment la pression initiale d'oxygène affecte-t-elle l'oxydation humide des boues pharmaceutiques ? Maîtrisez votre profondeur d'oxydation
- Que fait un réacteur à pression ? Contrôler les réactions chimiques avec une précision à haute pression
- Pourquoi les réacteurs revêtus de PTFE sont-ils essentiels à la synthèse des MOF ? Assurez une pureté élevée et une résistance à la corrosion dans votre laboratoire



