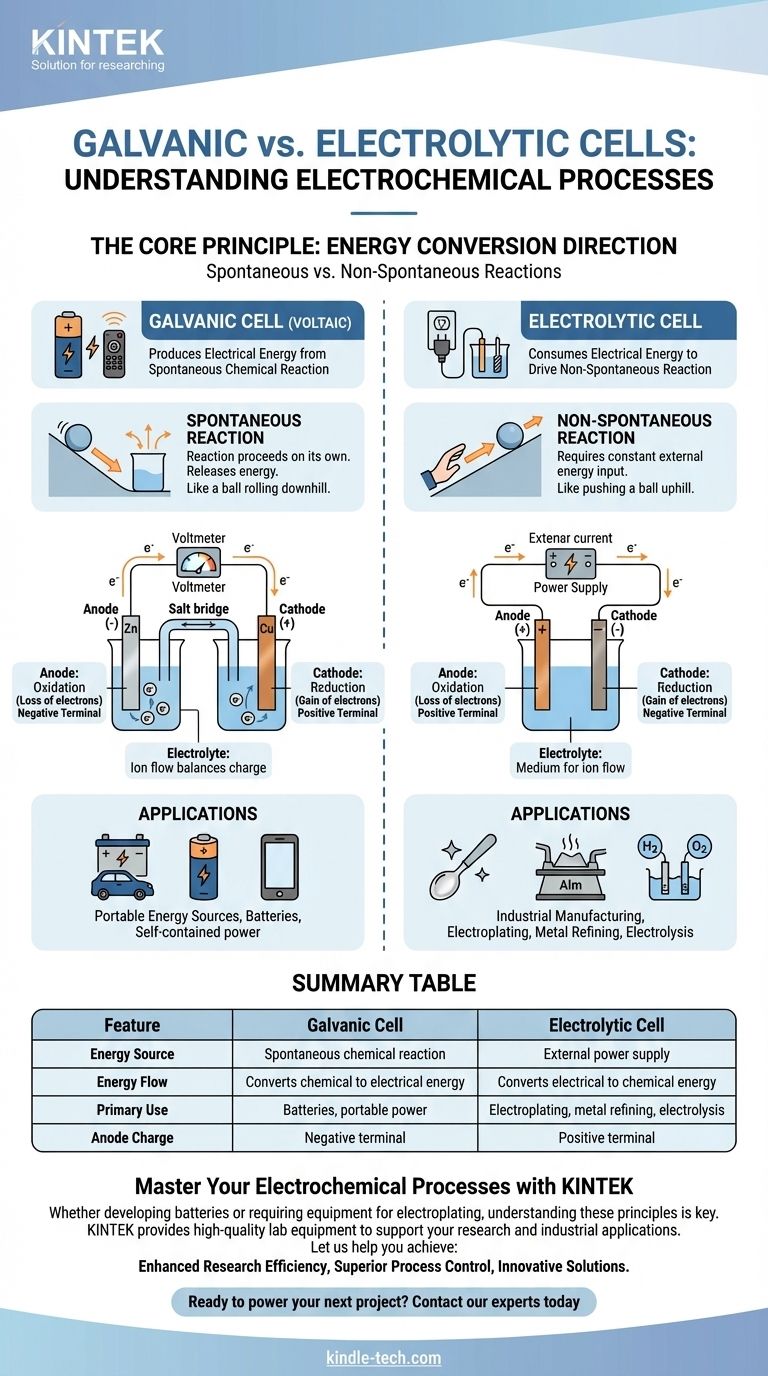
Fondamentalement, une pile galvanique est une cellule électrochimique qui produit de l'énergie électrique à partir d'une réaction chimique spontanée, comme une pile alimentant votre télécommande. En revanche, une cellule électrolytique consomme de l'énergie électrique provenant d'une source externe pour forcer une réaction chimique non spontanée à se produire, un processus utilisé dans le placage et la purification des métaux.
La distinction fondamentale réside dans la direction de la conversion de l'énergie. Une pile galvanique convertit l'énergie chimique stockée en énergie électrique, tandis qu'une cellule électrolytique convertit l'énergie électrique externe en énergie chimique.

Le Principe Fondamental : Réactions Spontanées vs. Non Spontanées
Le comportement de toute cellule électrochimique est dicté par la tendance naturelle de sa réaction chimique. Cette tendance est la clé pour comprendre pourquoi une cellule produit de l'énergie et l'autre en a besoin.
Comment les Piles Galvaniques Génèrent de l'Énergie
Une pile galvanique, également appelée pile voltaïque, est construite autour d'une réaction chimique spontanée.
Il s'agit d'une réaction qui se produit d'elle-même sans intervention extérieure, libérant de l'énergie dans le processus. Considérez cela comme une balle roulant en descente.
Cette libération d'énergie pousse les électrons à travers un circuit externe, créant un courant électrique. C'est le principe derrière toutes les piles non rechargeables et les piles rechargeables en décharge.
Comment les Cellules Électrolytiques Consomment de l'Énergie
Une cellule électrolytique provoque une réaction chimique non spontanée.
C'est une réaction qui ne se produira pas d'elle-même et qui nécessite un apport constant d'énergie pour se produire. C'est l'équivalent de pousser une balle en montée.
Une source d'alimentation externe, comme une alimentation électrique, fournit la tension nécessaire pour forcer les électrons à circuler contre leur direction naturelle, entraînant le changement chimique souhaité.
Un Regard Pratique sur le Fonctionnement des Cellules
Bien que leurs objectifs soient opposés, les deux cellules partagent des composants communs qui fonctionnent selon les mêmes règles fondamentales de la chimie, mais avec une différence cruciale de polarité.
L'Anode et la Cathode : Une Histoire de Deux Polarités
Dans les deux types de cellules, l'anode est toujours l'endroit où se produit l'oxydation (perte d'électrons) et la cathode est l'endroit où se produit la réduction (gain d'électrons).
Cependant, leur charge électrique est inversée. Dans une pile galvanique, l'anode est la borne négative car la réaction spontanée libère des électrons à partir d'elle.
Dans une cellule électrolytique, l'anode est la borne positive car la source d'alimentation externe tire les électrons loin d'elle, forçant l'oxydation à se produire.
Le Rôle de l'Électrolyte
Les deux cellules contiennent un électrolyte, généralement une solution contenant des ions.
Ce milieu est essentiel pour compléter le circuit électrique. Alors que les électrons circulent à travers le fil externe, les ions circulent à travers l'électrolyte pour équilibrer la charge aux électrodes.
Comprendre les Applications et les Compromis
Les fonctions opposées de ces cellules conduisent à des applications dans le monde réel très différentes et à des limitations inhérentes.
Piles Galvaniques : Sources d'Énergie Portables
L'utilisation principale des piles galvaniques est de servir de batteries. Elles fournissent une source d'énergie électrique portable et autonome.
Le compromis est que les réactifs chimiques à l'intérieur de la cellule sont finis. Une fois consommés, la cellule cesse de produire de l'énergie et doit être soit jetée, soit rechargée.
Cellules Électrolytiques : Fabrication Industrielle et Purification
Les cellules électrolytiques sont les bêtes de somme de l'industrie, utilisées pour des processus qui seraient autrement chimiquement impossibles ou inefficaces.
Les applications clés comprennent l'électrodéposition (revêtement d'un métal avec un autre), le raffinage de métaux comme l'aluminium et le cuivre, et l'électrolyse de l'eau pour produire de l'hydrogène et de l'oxygène. Leur principale limite est l'exigence d'un apport important et continu d'énergie électrique externe.
Comment Appliquer ces Connaissances
Votre choix entre ces concepts dépend entièrement de savoir si votre objectif est de générer de l'énergie ou d'induire un changement chimique.
- Si votre objectif principal est de générer de l'électricité à partir d'une réaction chimique : Vous travaillez avec les principes d'une pile galvanique, comme lors de la conception ou de la compréhension d'une batterie.
- Si votre objectif principal est d'utiliser l'électricité pour créer un produit ou affiner une substance : Vous travaillez avec les principes d'une cellule électrolytique, courante dans la fabrication chimique et la métallurgie.
Comprendre cette division est la première étape pour maîtriser l'application pratique de l'électrochimie.
Tableau Récapitulatif :
| Caractéristique | Pile Galvanique | Cellule Électrolytique |
|---|---|---|
| Source d'Énergie | Réaction chimique spontanée | Alimentation externe |
| Flux d'Énergie | Convertit l'énergie chimique en énergie électrique | Convertit l'énergie électrique en énergie chimique |
| Utilisation Principale | Piles, alimentation portable | Électrodéposition, raffinage des métaux, électrolyse |
| Charge de l'Anode | Borne négative | Borne positive |
Maîtrisez Vos Procédés Électrochimiques avec KINTEK
Que vous développiez de nouvelles technologies de batteries ou que vous ayez besoin d'équipements de précision pour l'électrodéposition et la purification des métaux, la compréhension de ces principes électrochimiques fondamentaux n'est qu'un début. KINTEK se spécialise dans la fourniture d'équipements de laboratoire et de consommables de haute qualité pour soutenir vos applications de recherche et industrielles.
Laissez-nous vous aider à réaliser :
- Efficacité de Recherche Améliorée : Avec des équipements fiables pour tester et développer des systèmes galvaniques et électrolytiques.
- Contrôle de Processus Supérieur : Pour des résultats cohérents en électrodéposition, électrolyse et synthèse de matériaux.
- Solutions Innovantes : Adaptées aux besoins uniques des laboratoires et des installations de production.
Prêt à alimenter votre prochain projet ? Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour vos besoins en laboratoire !
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Quelles sont les étapes requises avant d'utiliser une cellule électrolytique super-étanche ? Assurer la sécurité et l'intégrité des données
- Quelles sont les précautions de sécurité nécessaires lors de l'utilisation de la cellule électrolytique ? Assurez une expérience sûre et réussie
- Quelles sont les tâches de maintenance clés pour la cellule électrolytique ? Assurer fiabilité et précision
- Comment une configuration de cellule électrochimique à trois électrodes garantit-elle une mesure précise de la corrosion de l'acier inoxydable 904L ?
- Quel rôle joue un poste de travail électrochimique dans l'évaluation des revêtements TiNO ? Quantification de la protection contre la corrosion biologique
- Comment manipuler une cellule électrolytique entièrement en PTFE afin de prévenir les dommages mécaniques ? Protégez votre investissement et l'intégrité de vos données
- Pourquoi l'utilisation de récipients de réaction dotés de capacités de contrôle environnemental est-elle essentielle en mécanochimie ?
- Comment un système de cellule électrolytique standard à trois électrodes analyse-t-il la montmorillonite et le TiO2 ? Améliorer la précision des données



















