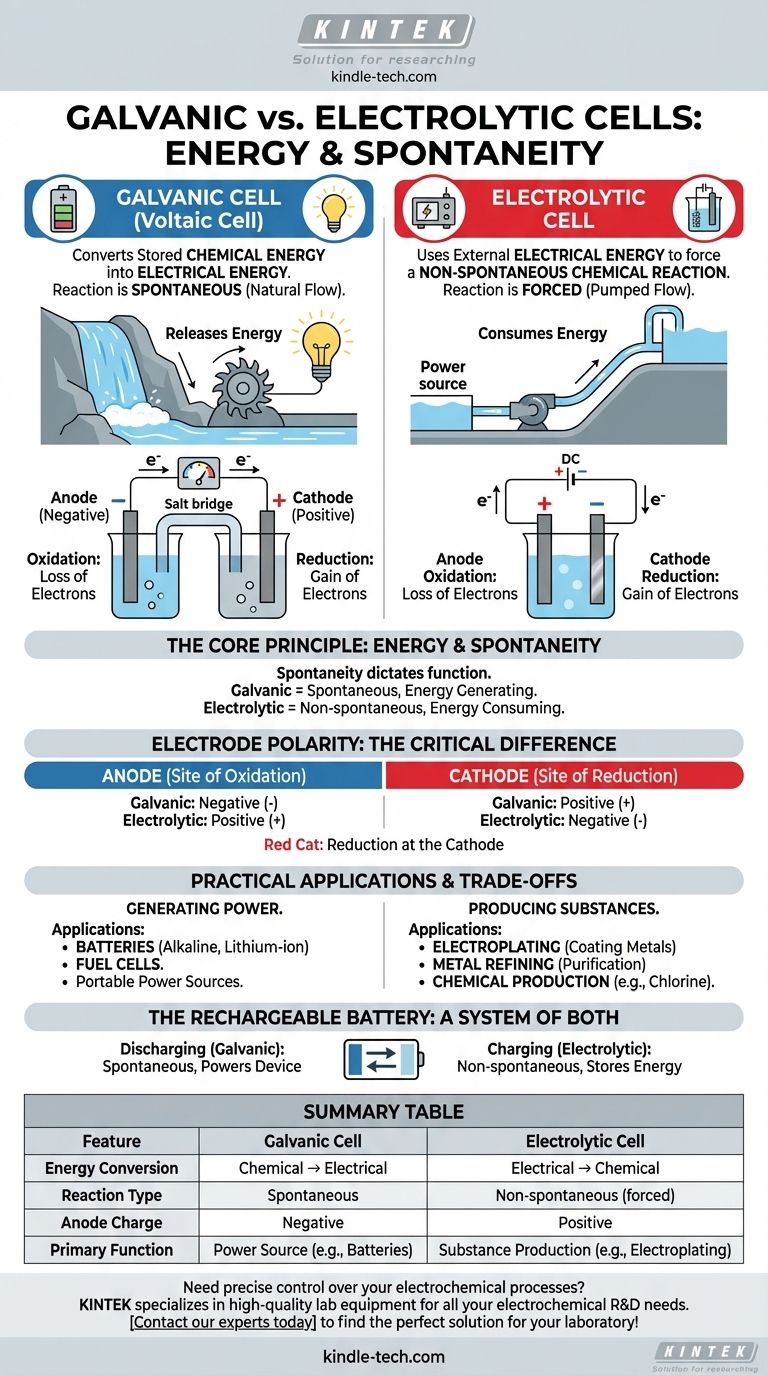
À la base, la différence entre une pile galvanique et une cellule électrolytique réside dans la direction de la conversion d'énergie. Une pile galvanique (ou voltaïque) convertit l'énergie chimique stockée en énergie électrique par une réaction spontanée, comme une batterie alimentant un appareil. En revanche, une cellule électrolytique utilise de l'énergie électrique externe pour forcer une réaction chimique non spontanée à se produire, comme dans le placage métallique.
La distinction fondamentale réside dans la spontanéité. Les piles galvaniques exploitent une réaction chimique qui se produit d'elle-même, libérant de l'énergie sous forme d'électricité. Les cellules électrolytiques utilisent l'électricité pour forcer une réaction chimique qui ne se produirait pas autrement.

Le principe fondamental : Énergie et spontanéité
Le comportement de toute cellule électrochimique est régi par le fait que sa réaction redox interne est spontanée ou non spontanée. Ce principe unique dicte sa fonction et sa structure.
Piles galvaniques : Génération d'énergie
Dans une pile galvanique, la réaction chimique est spontanée. Cela signifie que les réactifs ont une énergie potentielle plus élevée que les produits, et la réaction se déroule naturellement, libérant de l'énergie.
Cette énergie libérée entraîne les électrons à travers un circuit externe, créant un courant électrique. Pensez à une cascade : l'eau coule naturellement vers le bas, et nous pouvons placer une turbine sur son chemin pour générer de l'électricité.
Cellules électrolytiques : Consommation d'énergie
Dans une cellule électrolytique, la réaction chimique souhaitée est non spontanée. Les produits sont dans un état énergétique plus élevé que les réactifs, de sorte que la réaction ne se produira pas d'elle-même.
Pour qu'elle se produise, nous devons fournir de l'énergie à partir d'une source d'alimentation externe (comme une batterie ou une alimentation électrique). Cette tension externe force les électrons à se déplacer dans la direction inverse de leur direction naturelle, entraînant la réaction. C'est comme utiliser une pompe pour faire monter l'eau.
Comment ce principe définit les composants des cellules
Bien que les définitions fondamentales de l'anode et de la cathode restent les mêmes, leur charge (polarité) est inversée entre les deux types de cellules. C'est un point de confusion courant mais c'est une conséquence directe de la spontanéité.
L'anode : Toujours le site de l'oxydation
Dans les deux types de cellules, l'anode est définie comme l'électrode où a lieu l'oxydation (la perte d'électrons).
La cathode : Toujours le site de la réduction
De même, dans les deux types de cellules, la cathode est l'électrode où se produit la réduction (le gain d'électrons). Un moyen mnémotechnique simple est "Red Cat" (Réduction à la Cathode).
La différence critique : La polarité des électrodes
Dans une pile galvanique, l'oxydation spontanée à l'anode libère un flux d'électrons. Cette accumulation de charge négative rend l'anode négative et la cathode, qui attire les électrons, positive.
Dans une cellule électrolytique, une source d'alimentation externe est utilisée. Sa borne positive est connectée à l'anode, où elle tire de force les électrons des espèces chimiques, provoquant l'oxydation. Par conséquent, l'anode est positive et la cathode est négative.
Applications pratiques et compromis
La différence entre la production et la consommation d'énergie conduit à des applications réelles complètement différentes pour ces deux types de cellules.
Piles galvaniques en pratique : Énergie portable
Les piles galvaniques sont conçues pour être des sources d'énergie. Leur application principale est dans les batteries, des piles alcalines à usage unique aux batteries lithium-ion rechargeables de votre téléphone et de votre voiture.
Les piles à combustible sont un autre type de pile galvanique, générant continuellement de l'électricité tant que le combustible (comme l'hydrogène) est fourni.
Cellules électrolytiques en pratique : Fabrication et raffinage
Les cellules électrolytiques sont des outils industriels utilisés pour produire des matériaux. Les applications clés incluent l'électroplacage (revêtement d'un objet avec une fine couche métallique) et la purification de métaux comme le cuivre et l'aluminium.
Elles sont également essentielles pour produire des produits chimiques industriels clés, tels que le chlore gazeux et l'hydroxyde de sodium à partir d'eau salée (saumure).
La batterie rechargeable : Un système des deux
Une batterie rechargeable est l'illustration parfaite des deux principes. Lorsqu'elle alimente votre appareil, elle agit comme une pile galvanique, exécutant une réaction spontanée. Lorsque vous la branchez pour la charger, une source d'alimentation externe inverse le processus, la transformant en une cellule électrolytique pour entraîner une réaction non spontanée et restaurer les réactifs initiaux.
Faire le bon choix pour votre objectif
Votre compréhension de la cellule à considérer dépend entièrement de la nécessité de produire de l'énergie ou de produire une substance.
- Si votre objectif principal est de générer de l'énergie à partir d'une réaction chimique : Vous travaillez avec une pile galvanique, où un processus spontané crée un courant électrique.
- Si votre objectif principal est de créer une substance à l'aide de l'électricité : Vous utilisez une cellule électrolytique, où une tension externe entraîne un changement chimique non spontané.
- Si votre objectif principal est de stocker et de réutiliser l'énergie électrique : Vous avez affaire à un système rechargeable qui alterne entre être une cellule électrolytique (charge) et une pile galvanique (décharge).
En fin de compte, ces deux types de cellules sont les deux faces d'une même pièce électrochimique, définies par la direction du flux d'énergie.
Tableau récapitulatif :
| Caractéristique | Pile galvanique | Cellule électrolytique |
|---|---|---|
| Conversion d'énergie | Chimique → Électrique | Électrique → Chimique |
| Type de réaction | Spontanée | Non spontanée (forcée) |
| Charge de l'anode | Négative | Positive |
| Fonction principale | Source d'énergie (ex. : Batteries) | Production de substances (ex. : Électroplacage) |
Besoin d'un contrôle précis sur vos processus électrochimiques ? Le bon équipement de laboratoire est crucial pour des résultats précis, que vous développiez de nouveaux matériaux de batterie ou que vous affiniez des techniques de placage métallique. KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité pour tous vos besoins en recherche et développement électrochimique. Contactez nos experts dès aujourd'hui pour trouver la solution parfaite pour votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
Les gens demandent aussi
- Quelle est la procédure d'installation des électrodes et de la membrane échangeuse d'ions ? Un guide étape par étape pour un assemblage fiable de la cellule électrochimique
- Comment un agitateur magnétique de précision affecte-t-il l'efficacité de la réaction ? Améliorer les performances de dégradation électrochimique
- Comment les cellules électrolytiques contribuent-elles à la séparation des anodes en graphite ? Optimisez le recyclage de batteries de haute pureté
- Quelles vérifications faut-il effectuer avant d'utiliser la cellule électrolytique ? Assurez la sécurité et la précision dans votre laboratoire
- Comment la densité de courant affecte-t-elle les nanostructures de MgO ? Contrôle de la micromorphologie dans la synthèse électrochimique
- Quelle est la fonction d'une cellule électrolytique dans l'enrichissement du tritium ? Détection améliorée pour l'analyse à faible niveau
- Quels sont les avantages de l'utilisation d'une cellule de réaction électrochimique à cinq ports pour l'évaluation de la corrosion localisée dans les alliages ?
- Comment une cellule électrochimique à trois électrodes garantit-elle la précision scientifique ? Permet une analyse précise de la corrosion







