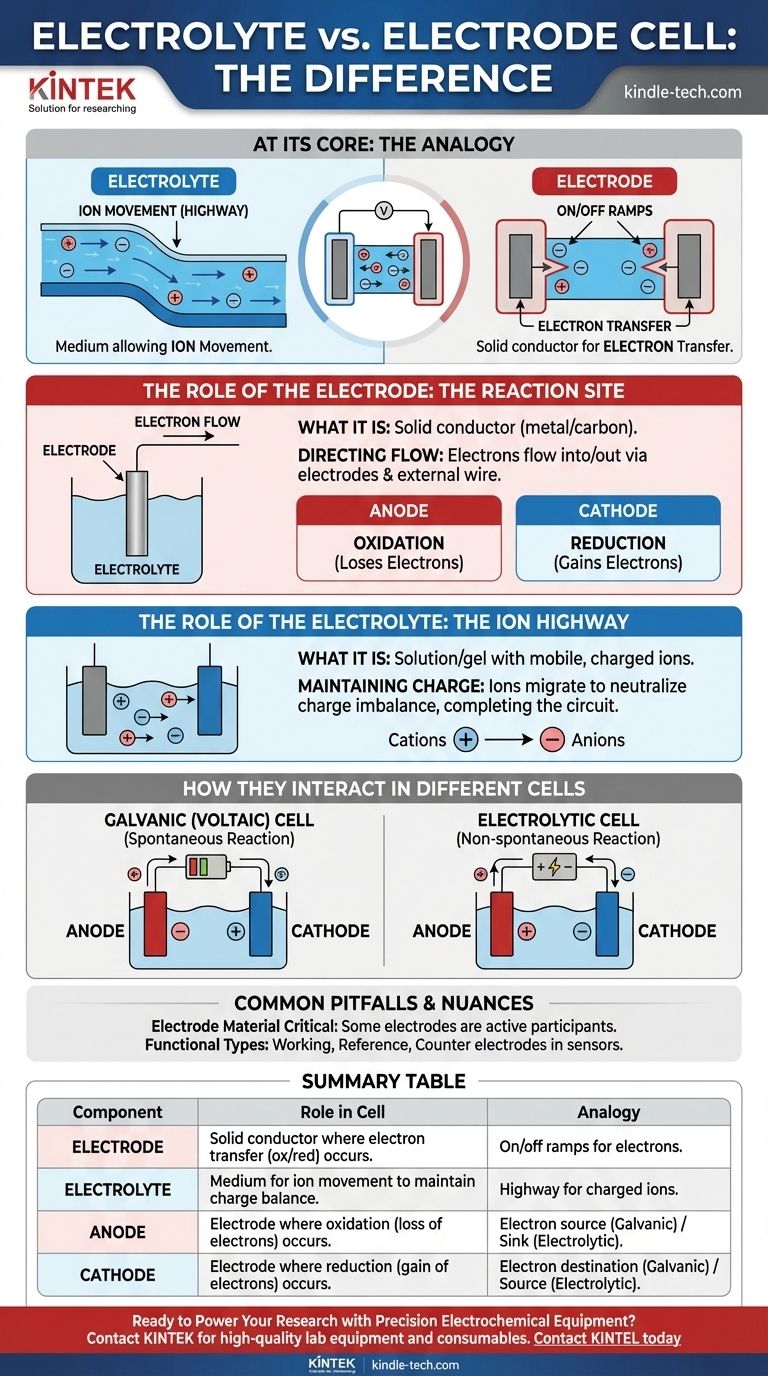
Fondamentalement, un électrolyte est le milieu qui permet aux ions de se déplacer, tandis qu'une électrode est le conducteur physique où la réaction chimique et le transfert d'électrons se produisent réellement. L'électrolyte est « l'autoroute » pour les ions chargés à l'intérieur de la cellule, et les électrodes sont les « rampes d'accès et de sortie » reliant cette autoroute au circuit électrique externe.
Dans toute cellule électrochimique, les électrodes sont les conducteurs solides où se produisent des réactions chimiques, soit en libérant, soit en consommant des électrons. L'électrolyte est le milieu liquide ou gélifié nécessaire qui transporte les ions entre ces électrodes, complétant ainsi le circuit électrique.

Le rôle de l'électrode : le site de réaction
Une électrode agit comme l'interface physique entre les composants chimiques à l'intérieur d'une cellule et le circuit électronique externe.
Qu'est-ce qu'une électrode ?
Une électrode est un conducteur électrique solide, généralement en métal ou en carbone, placé dans l'électrolyte. Son rôle est de transférer des électrons vers ou depuis les espèces dans la solution.
Diriger le flux d'électrons
Les électrons ne peuvent pas voyager à travers l'électrolyte. Au lieu de cela, ils entrent ou sortent de la cellule par les électrodes et le fil externe connecté.
Anode contre cathode
Toutes les cellules possèdent deux types d'électrodes définies par la réaction qui se produit à leur surface :
- L'anode est l'endroit où se produit l'oxydation (une substance perd des électrons).
- La cathode est l'endroit où se produit la réduction (une substance gagne des électrons).
Le rôle de l'électrolyte : l'autoroute ionique
L'électrolyte est tout aussi crucial que les électrodes. Sans lui, le circuit est incomplet et aucun courant ne peut circuler.
Qu'est-ce qu'un électrolyte ?
Un électrolyte est une substance, généralement une solution contenant des sels, des acides ou des bases, qui produit une solution conductrice d'électricité lorsqu'elle est dissoute. Il contient des ions mobiles et chargés.
Maintenir la neutralité de charge
Comme les électrons sont libérés à l'anode et consommés à la cathode, un déséquilibre de charge s'accumulerait rapidement et arrêterait la réaction. L'électrolyte empêche cela en permettant à ses ions de migrer entre les électrodes, neutralisant la charge et permettant au processus de continuer.
Comment ils interagissent dans différentes cellules
La charge spécifique de l'anode et de la cathode dépend si la cellule génère ou consomme de l'électricité.
Dans les cellules galvaniques (voltaïques)
Ces cellules, comme les batteries courantes, convertissent l'énergie chimique en énergie électrique par une réaction spontanée.
- L'anode est négative, car elle est la source d'électrons pour le circuit externe.
- La cathode est positive, car c'est là que les électrons retournent à la cellule.
Dans les cellules électrolytiques
Ces cellules utilisent de l'énergie électrique externe pour provoquer une réaction non spontanée, comme dans la galvanoplastie ou la décomposition de l'eau.
- L'anode est positive, car elle est connectée à la borne positive de la source d'alimentation externe pour en retirer les électrons.
- La cathode est négative, car elle est connectée à la borne négative pour y forcer des électrons.
Pièges courants et nuances
Comprendre les définitions de base est la première étape. Reconnaître les nuances est ce qui mène à une véritable compréhension.
Le matériau de l'électrode est critique
L'électrode n'est pas toujours seulement un conducteur inerte. Dans de nombreuses batteries, le matériau de l'électrode lui-même participe activement à la réaction chimique, comme le boîtier en zinc d'une batterie alcaline agissant comme anode.
Types d'électrodes fonctionnelles
En chimie analytique et dans les applications de capteurs, les électrodes reçoivent des noms plus spécifiques basés sur leur fonction.
- Une électrode de travail est l'endroit où se produit la réaction chimique d'intérêt.
- Une électrode de référence fournit un potentiel stable et constant pour la mesure.
- Une électrode auxiliaire complète le circuit, faisant passer le courant vers l'électrode de travail.
Faire la bonne distinction pour votre objectif
Pour appliquer ces connaissances, concentrez-vous sur le rôle fondamental que joue chaque composant dans votre contexte spécifique.
- Si votre objectif principal est la science de base des batteries : Considérez l'électrode comme le site de gain/perte d'électrons (anode/cathode) et l'électrolyte comme le moteur ionique essentiel qui maintient la batterie en marche.
- Si votre objectif principal est d'effectuer l'électrolyse : Rappelez-vous que la polarité (+/-) des électrodes est inversée par rapport à une batterie, mais que leurs rôles chimiques fondamentaux (anode = oxydation, cathode = réduction) restent exactement les mêmes.
- Si votre objectif principal est de construire des capteurs électrochimiques : Vous devez distinguer l'électrode de travail (où l'événement se produit), l'électrode de référence (pour une mesure stable) et l'électrode auxiliaire (pour compléter le circuit).
En fin de compte, l'électrode et l'électrolyte sont deux composants distincts mais inséparables qui forment la base de toute technologie électrochimique.
Tableau récapitulatif :
| Composant | Rôle dans une cellule électrochimique | Analogie |
|---|---|---|
| Électrode | Conducteur solide où se produit le transfert d'électrons (oxydation/réduction). | Rampes d'accès/sortie pour les électrons vers le circuit externe. |
| Électrolyte | Milieu (liquide/gel) qui permet le mouvement des ions pour maintenir l'équilibre des charges. | Autoroute pour les ions chargés à l'intérieur de la cellule. |
| Anode | Électrode où se produit l'oxydation (perte d'électrons). | Source d'électrons (Galvanique) ou puits d'électrons (Électrolytique). |
| Cathode | Électrode où se produit la réduction (gain d'électrons). | Destination des électrons (Galvanique) ou source d'électrons (Électrolytique). |
Prêt à alimenter votre recherche avec un équipement électrochimique de précision ?
Comprendre les fondamentaux est la première étape. Les appliquer avec les bons outils est ce qui mène à la découverte. Que vous développiez de nouveaux matériaux pour batteries, effectuiez une électrolyse précise ou construisiez des capteurs sensibles, KINTEK fournit l'équipement de laboratoire et les consommables de haute qualité dont vous avez besoin.
Nous nous spécialisons dans la satisfaction des besoins précis des laboratoires. Laissez-nous vous aider à choisir les cellules électrochimiques, les électrodes et les électrolytes parfaits pour garantir des résultats précis et fiables pour votre application spécifique.
Contactez KINTEL dès aujourd'hui pour discuter des exigences de votre projet et découvrir comment nos solutions peuvent améliorer les capacités de votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellules de test personnalisables de type Swagelok pour la recherche avancée sur les batteries et l'analyse électrochimique
Les gens demandent aussi
- Quels sont les avantages d'une cellule électrochimique plate pour la corrosion ? Obtenez une analyse précise des piqûres et des crevasses
- Comment une cellule électrolytique de haute précision est-elle utilisée pour évaluer la résistance à la corrosion des métaux ? Valider les résultats DCT avec précision
- Quelle est la plage de volume de la cellule électrolytique d'évaluation de revêtement ? Un guide pour choisir la bonne taille
- Pour quel type de système d'électrodes la cellule électrolytique d'évaluation de revêtement est-elle conçue ? Débloquez une analyse précise des revêtements
- Quel est le principe de fonctionnement d'une cellule électrolytique pour la corrosion sur plaque plate ? Un guide pour les essais contrôlés de matériaux



















