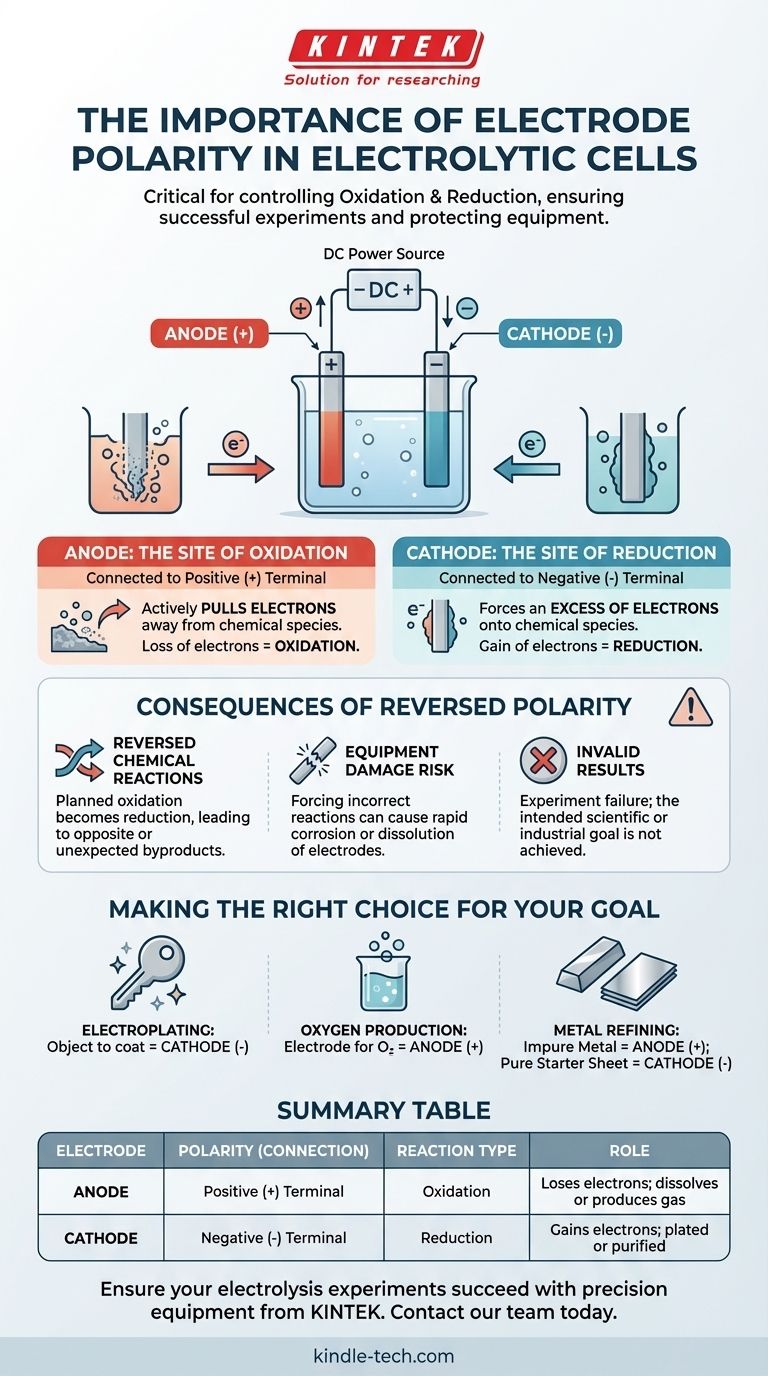
Dans une cellule électrolytique, la polarité correcte des électrodes est essentielle car elle dicte où se produisent les réactions chimiques fondamentales d'oxydation et de réduction. La borne positive de la source d'alimentation définit l'anode (le site de l'oxydation), et la borne négative définit la cathode (le site de la réduction). Inverser ces connexions inversera la transformation chimique prévue, entraînant un échec expérimental et des dommages potentiels à l'équipement.
Le principe fondamental est le suivant : la polarité des électrodes n'est pas une étiquette arbitraire, mais le mécanisme de contrôle direct de votre réaction chimique. Elle détermine quelle électrode perd des électrons (oxydation) et laquelle en gagne (réduction), contrôlant ainsi les substances qui sont formées ou consommées.

Les rôles fondamentaux de l'anode et de la cathode
Pour comprendre l'importance de la polarité, nous devons d'abord définir les rôles des deux électrodes dans un processus électrolytique. Ces rôles sont entièrement dictés par leur connexion à une source d'alimentation externe.
L'anode : le site de l'oxydation
L'anode est l'électrode connectée à la borne positive (+) de l'alimentation électrique.
Cette connexion positive attire activement les électrons des espèces chimiques dans la solution électrolytique qui se trouvent près de la surface de l'anode. Cette perte forcée d'électrons est appelée oxydation.
La cathode : le site de la réduction
La cathode est l'électrode connectée à la borne négative (-) de l'alimentation électrique.
Cette connexion négative crée un excès d'électrons à la surface de la cathode. Ces électrons sont ensuite forcés sur les espèces chimiques en solution, les faisant gagner des électrons. Ce processus est appelé réduction.
L'alimentation électrique : la force motrice
Contrairement à une batterie standard (une pile galvanique) qui produit de l'énergie à partir d'une réaction spontanée, une cellule électrolytique utilise de l'énergie pour entraîner une réaction non spontanée.
L'alimentation électrique externe agit comme une pompe à électrons. Elle les retire de l'anode et les pousse vers la cathode, forçant un changement chimique qui ne se produirait pas de lui-même.
Comprendre les conséquences d'une polarité inversée
Connecter les électrodes aux mauvaises bornes n'est pas une erreur mineure ; cela altère fondamentalement toute l'expérience. On parle souvent d'« inversion de polarité ».
Vous inversez les réactions chimiques
Si vous inversez les connexions, l'électrode que vous destiniez à être l'anode devient la cathode, et vice versa.
La réaction chimique que vous aviez prévue pour l'anode (oxydation) ne se produira pas. Au lieu de cela, une réaction de réduction s'y produira. Cela signifie que votre expérience produira l'opposé des résultats escomptés, ou créera des sous-produits entièrement inattendus.
Vous risquez d'endommager votre équipement
Forcer une réaction sur le mauvais matériau peut avoir des conséquences destructrices. Par exemple, si vous effectuez une galvanoplastie, inverser la polarité commencera à dissoudre l'objet que vous aviez l'intention de revêtir.
Dans certains cas, tenter d'oxyder une électrode qui n'est pas conçue pour cela peut la faire corroder rapidement. Cela peut contaminer votre solution et endommager de façon permanente l'électrode.
Vos résultats seront invalides
En fin de compte, une polarité inversée invalide l'expérience. Si vous essayez de plaquer une couche de cuivre sur une clé, inverser la configuration fera en sorte que la source de cuivre soit plaquée avec le métal de la clé, dissolvant ainsi la clé. Le résultat est un échec à atteindre l'objectif scientifique ou industriel.
Faire le bon choix pour votre objectif
Attribuer correctement la polarité est la façon dont vous commandez le résultat chimique. Avant de connecter votre source d'alimentation, confirmez quelle électrode doit être l'anode (+) et laquelle doit être la cathode (-).
- Si votre objectif principal est la galvanoplastie d'un objet : L'objet que vous souhaitez revêtir doit être la cathode (-), car c'est là que les ions métalliques positifs seront réduits en une couche métallique solide.
- Si votre objectif principal est de produire de l'oxygène gazeux à partir de l'eau : L'électrode où vous voulez que l'oxygène se forme doit être l'anode (+), car c'est là que les molécules d'eau sont oxydées.
- Si votre objectif principal est d'affiner un métal impur : Le bloc de métal impur doit être l'anode (+) afin qu'il puisse être oxydé et se dissoudre dans la solution, tandis qu'une feuille de démarrage pure doit être la cathode (-) pour recueillir le métal nouvellement purifié.
Maîtriser la polarité des électrodes vous donne un contrôle direct sur les réactions électrochimiques que vous souhaitez effectuer.
Tableau récapitulatif :
| Électrode | Polarité (Connexion) | Type de réaction | Rôle |
|---|---|---|---|
| Anode | Borne positive (+) | Oxydation | Perd des électrons ; la cible se dissout ou produit du gaz (ex: O₂) |
| Cathode | Borne négative (-) | Réduction | Gagne des électrons ; la cible est plaquée ou purifiée |
Assurez le succès de vos expériences d'électrolyse avec des équipements de précision de KINTEK.
Que vous affiniez des métaux, effectuiez de la galvanoplastie ou meniez des recherches, nos équipements de laboratoire spécialisés et nos consommables sont conçus pour la précision et la durabilité. Nos experts peuvent vous aider à sélectionner les bonnes alimentations et électrodes pour contrôler parfaitement vos réactions chimiques.
Ne risquez pas des résultats invalides ou des équipements endommagés—contactez notre équipe dès aujourd'hui pour discuter de vos besoins spécifiques en laboratoire.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellules d'électrolyse PEM personnalisables pour diverses applications de recherche
- Cellule à flux personnalisable pour la réduction du CO2 pour la recherche sur le NRR, l'ORR et le CO2RR
Les gens demandent aussi
- Quelles précautions prendre lors de la manipulation et de l'utilisation d'une cellule électrolytique tout-quartz ? Assurer des performances sûres, précises et durables
- Quels sont les volumes et les dimensions disponibles pour la cellule électrolytique entièrement en quartz ? Trouvez l'ajustement parfait pour votre laboratoire
- Pourquoi utilise-t-on une cellule électrolytique en quartz pour les eaux usées d'acide acrylique ? Assurer la stabilité chimique et l'intégrité des données
- Quelles sont les procédures opérationnelles et les précautions de sécurité lors d'une expérience utilisant une cellule électrolytique tout-quartz ? Assurez la sécurité et la précision dans votre laboratoire
- Comment entretenir une cellule électrolytique tout-quartz et ses composants pour une utilisation à long terme ? Un guide pour maximiser la durée de vie de l'équipement



















