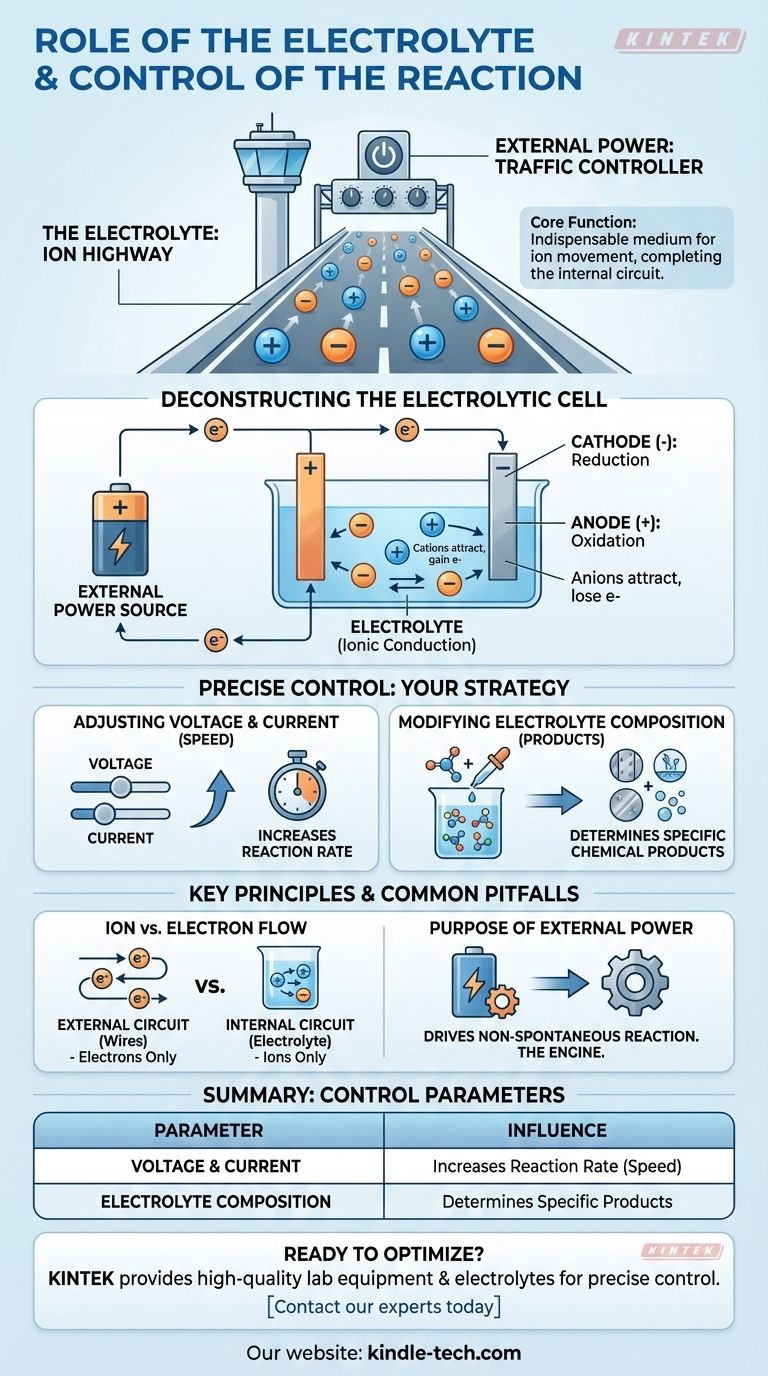
À la base, l'électrolyte est le milieu indispensable au mouvement des ions au sein d'une cellule, complétant le circuit électrique qui permet à une réaction chimique de se produire. La réaction elle-même est précisément contrôlée en manipulant les entrées électriques externes — spécifiquement la tension et le courant — et en modifiant la composition chimique de la solution électrolytique.
L'électrolyte agit comme une "autoroute à ions", permettant aux particules chargées de voyager entre les électrodes à l'intérieur de la cellule. L'alimentation électrique externe agit comme le "contrôleur de trafic", dictant la vitesse et la direction de la réaction chimique en gérant le flux d'électrons.

Le rôle fondamental de l'électrolyte
Une réaction électrochimique nécessite un circuit complet. L'électrolyte est responsable de la moitié interne de ce circuit, un rôle fondamentalement différent des fils connectés à l'extérieur.
Qu'est-ce qu'un électrolyte ?
Un électrolyte est une solution, généralement aqueuse ou organique, qui contient des ions dissociés.
Ces ions positifs et négatifs flottant librement sont ce qui rend la solution électriquement conductrice.
Permettre la conduction ionique
La fonction principale de l'électrolyte est la conduction ionique.
Alors que les électrons circulent à travers les fils externes, les ions doivent circuler à travers la solution entre les deux électrodes. Ce mouvement d'ions chargés complète le circuit, permettant à la réaction d'être maintenue.
Déconstruire la cellule électrolytique
Dans une cellule électrolytique, une source d'énergie externe entraîne une réaction chimique qui ne se produirait pas d'elle-même. Voici comment les composants fonctionnent ensemble.
La source d'énergie externe
Le processus commence par une source d'énergie externe, comme une batterie ou une alimentation électrique.
Cette source pompe activement des électrons, créant une différence de charge entre les deux électrodes qui force la réaction à se produire.
La cathode (le site de réduction)
La source externe pousse les électrons vers la cathode, lui donnant une charge négative.
Cette charge négative attire les ions chargés positivement (cations) de l'électrolyte. Lorsque ces ions atteignent la cathode, ils gagnent des électrons dans un processus appelé réduction.
L'anode (le site d'oxydation)
Simultanément, la source externe retire les électrons de l'anode, lui donnant une charge positive.
Cette charge positive attire les ions chargés négativement (anions) de l'électrolyte. À l'anode, ces ions perdent des électrons dans un processus connu sous le nom d'oxydation.
Comment la réaction est précisément contrôlée
Vous avez un contrôle direct sur le résultat et la vitesse de la réaction électrochimique en ajustant trois paramètres clés.
Ajuster la tension et le courant
La tension peut être considérée comme la "pression" électrique qui entraîne la réaction, tandis que le courant est le taux de flux d'électrons.
Augmenter la tension et le courant augmentera généralement la vitesse à laquelle la réaction chimique se produit. Cela vous donne un contrôle direct et en temps réel sur la vitesse du processus.
Modifier la composition de l'électrolyte
La réaction chimique spécifique qui a lieu est déterminée par les ions disponibles dans l'électrolyte.
En modifiant la composition de l'électrolyte — par exemple, en utilisant un sel ou un solvant différent — vous pouvez modifier les produits qui sont formés à l'anode et à la cathode.
Pièges courants et principes clés
Pour vraiment comprendre le système, il est essentiel de distinguer les deux moitiés du circuit et la nature de la cellule.
Mouvement des ions vs. flux d'électrons
Un point de confusion courant est la différence entre ce qui se passe à l'intérieur et à l'extérieur de la cellule.
Les électrons ne circulent que dans le circuit externe (les fils). Les ions ne circulent que dans le circuit interne (l'électrolyte). La réaction aux surfaces des électrodes est ce qui relie ces deux voies distinctes.
Le but de l'alimentation externe
Il est crucial de se rappeler que ce processus décrit une cellule électrolytique.
Dans ces cellules, l'énergie électrique est utilisée pour entraîner une réaction chimique non spontanée. La source d'énergie externe n'est pas facultative ; c'est le moteur qui rend l'ensemble du processus possible.
Faire le bon choix pour votre objectif
Votre stratégie de contrôle dépend entièrement de ce que vous voulez réaliser avec la réaction.
- Si votre objectif principal est d'accélérer la vitesse de réaction : Augmentez la tension et le courant appliqués pour accélérer le flux d'électrons et d'ions.
- Si votre objectif principal est de créer un produit chimique spécifique : Sélectionnez et contrôlez soigneusement la composition de l'électrolyte pour vous assurer que les ions souhaités sont disponibles pour la réaction.
- Si votre objectif principal est de comprendre l'efficacité du système : Vous devez surveiller à la fois le flux d'électrons (courant) dans le circuit externe et le changement chimique résultant (conversion d'ions) aux électrodes.
En fin de compte, maîtriser un processus électrochimique signifie comprendre que l'électrolyte et le circuit externe sont les deux moitiés d'un système unique et contrôlable.
Tableau récapitulatif :
| Paramètre de contrôle | Comment il influence la réaction |
|---|---|
| Tension & Courant | Augmente la vitesse (rapidité) de la réaction chimique. |
| Composition de l'électrolyte | Détermine les produits chimiques spécifiques formés. |
Prêt à optimiser votre processus électrochimique ?
Que vous développiez de nouveaux matériaux, réalisiez de la galvanoplastie ou meniez des tests analytiques précis, le contrôle de votre réaction électrochimique est essentiel. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire et de consommables de haute qualité pour tous vos besoins en laboratoire, y compris des alimentations électriques fiables et des électrolytes purs.
Contactez nos experts dès aujourd'hui pour discuter de la façon dont nous pouvons vous aider à obtenir un contrôle précis et des résultats supérieurs dans votre laboratoire.
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrolytique de type H Triple Cellule électrochimique
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
Les gens demandent aussi
- Quelle est la structure d'une cellule électrolytique à membrane échangeable de type H ? Un guide pour une séparation électrochimique précise
- Quel est le système expérimental typique utilisé avec une cellule électrolytique à double couche à bain-marie ? Obtenez un contrôle électrochimique précis
- Qu'est-ce qu'une cellule de type H ? Un guide des cellules électrochimiques divisées pour des expériences précises
- Quels sont les volumes typiques et les configurations d'ouverture pour une cellule électrolytique à double couche à bain-marie ? Optimisez votre configuration électrochimique
- Quelles sont les spécifications d'ouverture standard pour une cellule électrolytique à membrane échangeable de type H ? Des orifices asymétriques pour une électrochimie précise



















