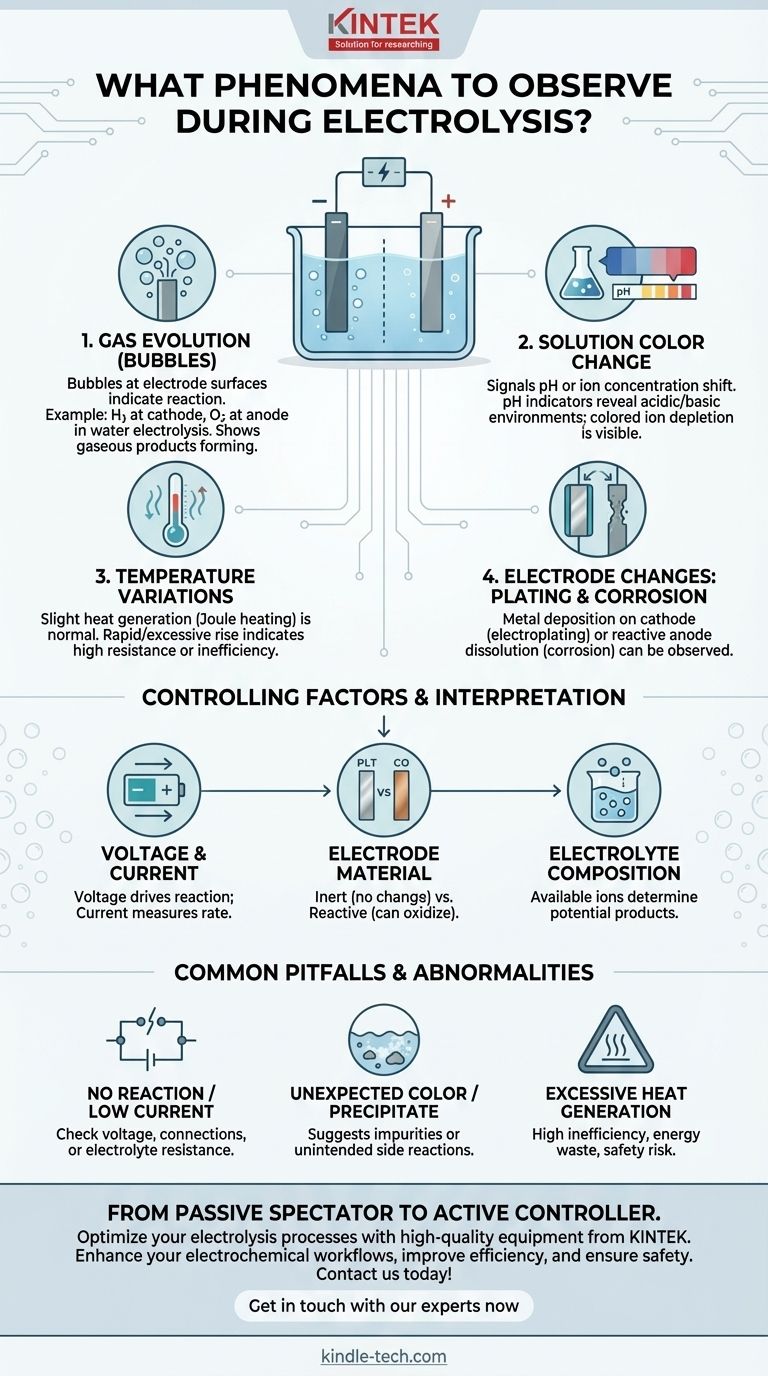
Lors de la réalisation d'une électrolyse, les principaux phénomènes à observer sont la génération de bulles de gaz à la surface des électrodes, les changements de couleur de la solution et toute variation de température. Ces indices visuels et physiques sont des indicateurs directs de la réaction électrochimique sous-jacente, fournissant un retour d'information immédiat sur la progression attendue du processus.
Observer l'électrolyse, c'est plus que simplement regarder les bulles se former. Chaque phénomène est une donnée qui révèle l'identité, l'efficacité et la sécurité de la réaction, vous permettant d'interpréter ce qui se passe au niveau moléculaire.

Interpréter les observations clés
Chaque événement observable pendant l'électrolyse fournit un indice sur les transformations chimiques en cours. Comprendre ce que signifient ces indices est essentiel pour contrôler le résultat.
Dégagement gazeux (Bulles) aux électrodes
Les bulles sont le signe le plus courant et le plus immédiat qu'une réaction se produit. Ce sont des produits gazeux formés directement à la surface des électrodes.
Par exemple, lors de l'électrolyse de l'eau, vous verrez du gaz hydrogène bouillonner à l'électrode négative (cathode) et du gaz oxygène à l'électrode positive (anode). Le gaz spécifique produit dépend entièrement de la composition de l'électrolyte.
Changements de couleur de la solution
Un changement de couleur de l'électrolyte peut signaler plusieurs événements différents. Il indique souvent un changement de pH ou une modification de la concentration d'ions spécifiques.
Si un indicateur de pH (comme le papier tournesol ou un indicateur universel) est présent, les changements de couleur près des électrodes révèlent la formation d'environnements acides ou basiques. Alternativement, si l'électrolyte contient des ions colorés (comme les ions cuivre(II) bleus), leur déplétion ou leur formation peut être suivie visuellement.
Variations de température
L'électrolyse implique de faire passer un courant électrique à travers une solution, ce qui génère intrinsèquement de la chaleur due à la résistance électrique (effet Joule).
Une légère augmentation progressive de la température est normale. Cependant, une élévation rapide ou excessive de la température peut indiquer une résistance interne élevée, un processus inefficace ou une réaction secondaire involontaire et fortement exothermique.
Changements d'électrode : Dépôt ou Corrosion
Les électrodes elles-mêmes peuvent changer. Dans les processus comme l'électrodéposition (galvanoplastie), vous observerez une couche de métal se déposer et croître sur la cathode.
Inversement, si une anode réactive (comme le cuivre ou le zinc) est utilisée, vous pourriez la voir se corroder visiblement ou se dissoudre dans la solution au fur et à mesure de son oxydation. Les électrodes inertes, comme le platine ou le carbone, ne devraient montrer aucun changement.
Comprendre les facteurs de contrôle
Les phénomènes que vous observez sont directement contrôlés par les paramètres que vous définissez. Le type d'électrode et d'électrolyte détermine ce qui peut se produire, tandis que la tension et le courant déterminent si cela se produit et à quelle vitesse.
Tension et Courant
La tension est la force motrice de la réaction ; une tension minimale (le potentiel de décomposition) doit être appliquée pour que l'électrolyse commence.
Le courant est une mesure du taux de la réaction. Il est directement proportionnel à la vitesse à laquelle les électrons sont transférés et, par conséquent, à la vitesse à laquelle les produits sont formés.
Matériau de l'électrode (Inerte vs Réactif)
Les électrodes inertes (par exemple, platine, graphite) servent uniquement de surface pour que la réaction se produise sans participer chimiquement.
Les électrodes réactives (par exemple, cuivre, zinc, nickel) peuvent être oxydées à l'anode, entrant dans la solution sous forme d'ions. C'est un principe fondamental dans l'électroraffinage et l'électrodéposition.
Composition de l'électrolyte
Les ions disponibles dans l'électrolyte déterminent les produits potentiels. Dans une solution contenant plusieurs types d'ions, celui qui est le plus facile à réduire réagira à la cathode, et celui qui est le plus facile à oxyder réagira à l'anode.
Pièges courants et situations anormales
L'observation du processus vous permet d'identifier quand les choses ne fonctionnent pas correctement. Ces « situations anormales » sont des outils diagnostiques essentiels.
Aucune réaction ou courant très faible
Cela indique généralement un problème avec la configuration. La cause pourrait être une tension insuffisante, une mauvaise connexion électrique ou un électrolyte avec une résistance très élevée.
Couleur inattendue ou précipité
Si vous observez une couleur non prédite par la réaction principale ou si vous voyez un solide (précipité) se former dans la solution, cela suggère fortement la présence d'impuretés. Cela indique qu'une réaction secondaire involontaire se produit.
Génération excessive de chaleur
Comme mentionné, une chaleur importante indique une forte inefficacité. Cela signifie qu'une grande partie de l'énergie électrique est gaspillée sous forme de chaleur au lieu d'être utilisée pour provoquer le changement chimique souhaité. Cela peut également présenter un risque pour la sécurité.
Faire le bon choix pour votre objectif
Votre interprétation de ces observations dépend de l'objectif de votre expérience.
- Si votre objectif principal est de démontrer un principe de base (par exemple, l'électrolyse de l'eau) : Recherchez les signes classiques de formation de bulles de gaz aux deux électrodes et utilisez un indicateur de pH pour observer la formation de base à la cathode et d'acide à l'anode.
- Si votre objectif principal est l'électrodéposition : L'observation la plus importante est le dépôt uniforme de métal sur la cathode, le courant et le temps étant les paramètres de contrôle clés.
- Si votre objectif principal est l'analyse quantitative (par exemple, la vérification des lois de Faraday) : Vous devez assurer un courant constant et stable, car cela relie directement la quantité de produit formé à la charge totale passée à travers la cellule.
En observant attentivement ces phénomènes, vous passez de spectateur passif à contrôleur actif du processus électrochimique.
Tableau récapitulatif :
| Phénomène | Ce qu'il indique | Aperçu clé |
|---|---|---|
| Bulles de gaz | Réaction en cours ; formation de produit (par exemple, H₂ à la cathode, O₂ à l'anode dans l'eau) | Identifie les produits gazeux de la réaction |
| Changement de couleur | Changement de pH ou changement de concentration d'ions (par exemple, avec des indicateurs ou des ions colorés comme Cu²⁺) | Révèle l'environnement chimique et la progression de la réaction |
| Augmentation de la température | Effet Joule ; une chaleur excessive peut indiquer une inefficacité ou des réactions secondaires | Surveille la sécurité du processus et l'efficacité énergétique |
| Dépôt/Corrosion de l'électrode | Dépôt de métal (cathode) ou dissolution (anode) dans des processus tels que l'électrodéposition | Crucial pour les applications nécessitant une modification de surface |
Optimisez vos processus d'électrolyse avec KINTEK
Cherchez-vous à obtenir un contrôle précis sur vos expériences d'électrolyse ou vos applications industrielles ? Comprendre ces phénomènes observables n'est que la première étape. KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité, y compris des électrodes fiables, des alimentations stables et des cellules d'électrolyse durables conçues pour des performances constantes et des résultats précis.
Que vous meniez des recherches, développiez de nouveaux matériaux ou augmentiez la production, nos produits vous aident à surveiller et à contrôler efficacement les paramètres clés. Contactez-nous dès aujourd'hui pour discuter de la manière dont nos solutions peuvent améliorer vos flux de travail électrochimiques, augmenter l'efficacité et garantir la sécurité.
Contactez nos experts maintenant pour trouver l'équipement parfait pour vos besoins en laboratoire !
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrolytique électrochimique à bain-marie double couche
- Cellule électrochimique électrolytique à bain-marie optique
- Cellule électrolytique optique à double couche de type H avec bain-marie
Les gens demandent aussi
- Quels sont les volumes et les dimensions disponibles pour la cellule électrolytique entièrement en quartz ? Trouvez l'ajustement parfait pour votre laboratoire
- Quelles sont les principales applications de la cellule électrolytique entièrement en quartz ? Essentielle pour l'analyse de haute pureté et l'analyse optique
- Quelles sont les procédures opérationnelles et les précautions de sécurité lors d'une expérience utilisant une cellule électrolytique tout-quartz ? Assurez la sécurité et la précision dans votre laboratoire
- Quelles sont les spécifications d'ouverture standard pour les cellules électrolytiques tout quartz scellées et non scellées ? Optimisez votre configuration électrochimique
- Comment entretenir une cellule électrolytique tout-quartz et ses composants pour une utilisation à long terme ? Un guide pour maximiser la durée de vie de l'équipement



















