Choisir le bon électrolyte est essentiel car il contrôle directement le résultat de votre expérience. L'électrolyte n'est pas un milieu passif ; c'est un composant actif qui doit être soigneusement sélectionné pour garantir que la réaction prévue se déroule correctement et pour prévenir les réactions secondaires indésirables qui peuvent invalider vos résultats.
La fonction principale d'un électrolyte est de compléter le circuit électrique en conduisant les ions, mais ses propriétés chimiques dictent quelles réactions sont possibles. Une incompatibilité entre l'électrolyte et le système expérimental peut entraîner des transformations chimiques complètement différentes et inattendues.

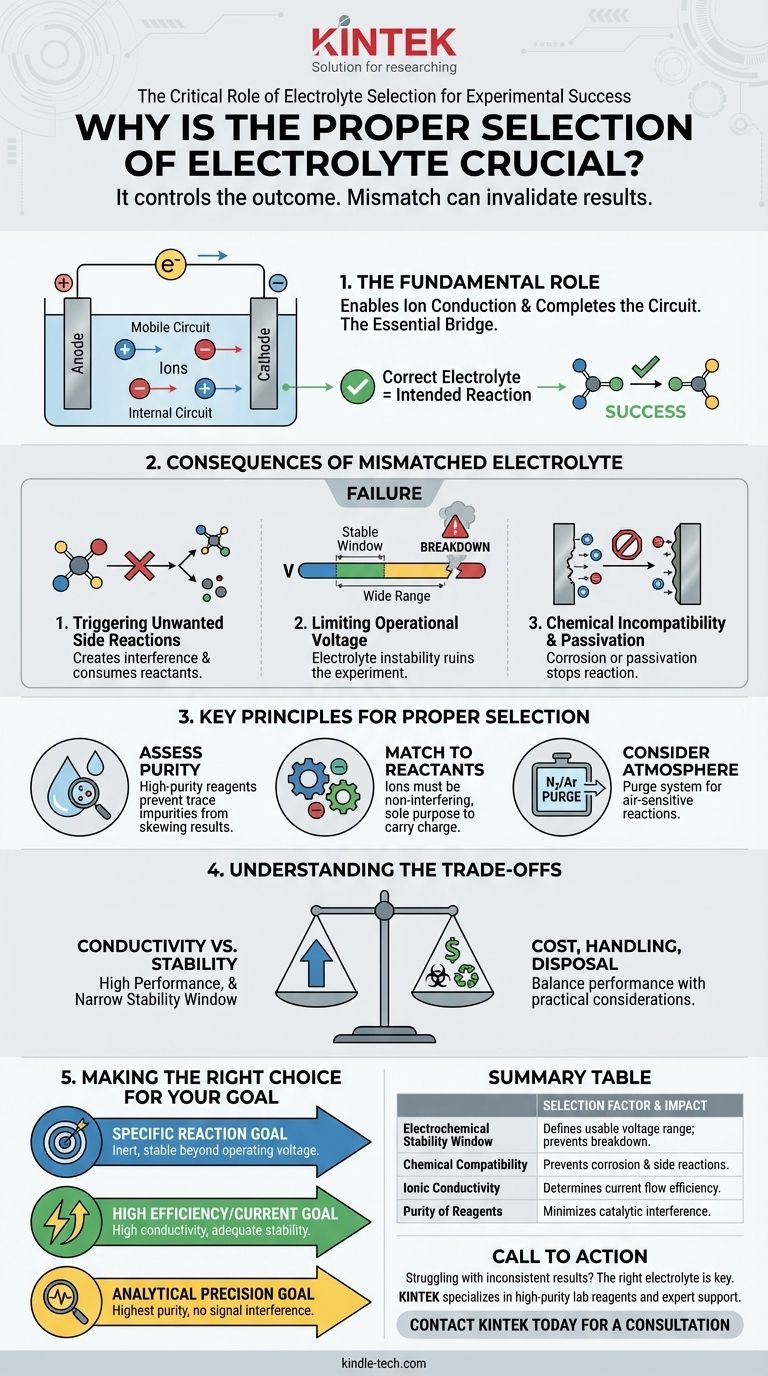
Le rôle fondamental d'un électrolyte
Un électrolyte est le pont essentiel dans toute cellule électrochimique. Sa tâche principale est de transporter la charge sous forme d'ions, permettant au circuit d'être complété entre les deux électrodes.
Permettre la conduction ionique
L'électrolyte contient des ions mobiles (cations et anions) qui se déplacent en réponse au champ électrique. Ce mouvement de particules chargées constitue le flux de courant à l'intérieur de la cellule.
Compléter le circuit électrique
Les électrons circulent à travers le fil externe, mais les ions doivent circuler à travers l'électrolyte. Sans cette voie ionique interne, le circuit serait interrompu et aucune réaction électrochimique ne pourrait se produire.
Pourquoi un électrolyte mal assorti invalide les résultats
Choisir le mauvais électrolyte est l'une des façons les plus courantes de faire échouer une expérience. Cela peut introduire des variables qui obscurcissent complètement le processus que vous avez l'intention d'étudier.
Déclencher des réactions secondaires indésirables
Les composants de l'électrolyte peuvent réagir avec vos électrodes, votre solvant ou la substance que vous analysez. Cela crée des sous-produits qui consomment les réactifs et interfèrent avec les mesures.
Limiter la tension de fonctionnement
Chaque électrolyte a une fenêtre de stabilité électrochimique. C'est la plage de tension où il reste inerte. Si votre expérience nécessite une tension en dehors de cette fenêtre, l'électrolyte lui-même se décomposera (s'oxydera ou se réduira), ruinant l'expérience.
Incompatibilité chimique et passivation
Un électrolyte peut être chimiquement agressif envers les matériaux de vos électrodes, les faisant corroder ou dissoudre. Il peut également provoquer la formation d'une couche passivante – un film non conducteur – à la surface de l'électrode, ce qui arrête complètement la réaction.
Principes clés pour une sélection appropriée
Faire un choix délibéré nécessite de comprendre les propriétés qui définissent un électrolyte approprié pour votre objectif spécifique.
Évaluer la pureté des réactifs
La pureté des composants de votre électrolyte est primordiale. Même des impuretés traces peuvent agir comme catalyseurs pour des réactions secondaires ou se déposer sur les électrodes, faussant vos résultats. Utilisez toujours des réactifs de haute pureté et de l'eau déionisée ou distillée.
Assortir l'électrolyte aux réactifs
Les ions contenus dans l'électrolyte doivent être non interférents. Ils ne doivent pas participer à la réaction électrochimique primaire que vous essayez de provoquer. Leur seul but doit être de transporter la charge.
Considérer l'atmosphère requise
Certaines expériences sont très sensibles à l'air. Si votre système nécessite une atmosphère inerte (comme l'azote ou l'argon), vous devez purger la cellule avant d'ajouter l'électrolyte pour éviter que l'oxygène ou l'humidité ne provoquent des réactions parasites.
Comprendre les compromis
Le choix d'un électrolyte implique souvent d'équilibrer des facteurs concurrents. Il y a rarement une seule option "parfaite".
Conductivité vs. Stabilité
Un électrolyte avec une très haute conductivité ionique pourrait offrir d'excellentes performances mais pourrait avoir une fenêtre de stabilité étroite. Vous pourriez avoir besoin de sacrifier une partie des performances pour un électrolyte qui reste stable aux tensions requises.
Coût et manipulation
Les considérations pratiques sont importantes. Certains électrolytes haute performance peuvent être coûteux, très toxiques ou nécessiter des procédures de manipulation spécialisées (comme dans une boîte à gants). Ces facteurs doivent être pesés par rapport aux exigences expérimentales.
Élimination après l'expérience
Le processus de sélection ne se termine pas avec l'expérience. Vous devez choisir un électrolyte pour lequel vous avez un plan d'élimination clair et sûr, qu'il s'agisse de neutralisation, de recyclage ou d'élimination spécialisée des déchets chimiques.
Faire le bon choix pour votre objectif
Votre objectif expérimental doit être le guide ultime pour votre sélection.
- Si votre objectif principal est de réaliser une réaction spécifique : Choisissez un électrolyte complètement inerte à tous les composants de votre système et stable bien au-delà de votre tension de fonctionnement.
- Si votre objectif principal est une efficacité ou un courant élevé : Privilégiez un électrolyte avec une conductivité ionique élevée, en vous assurant que sa fenêtre de stabilité est toujours adéquate pour vos besoins.
- Si votre objectif principal est la précision analytique : Utilisez les réactifs de la plus haute pureté disponibles et vérifiez que les ions de l'électrolyte n'interféreront pas avec le signal que vous essayez de mesurer.
En fin de compte, un électrolyte bien choisi garantit que les données que vous collectez reflètent le processus que vous aviez l'intention d'étudier.
Tableau récapitulatif :
| Facteur de sélection | Impact sur l'expérience |
|---|---|
| Fenêtre de stabilité électrochimique | Définit la plage de tension utilisable ; une incompatibilité provoque la dégradation de l'électrolyte. |
| Compatibilité chimique | Prévient la corrosion, la passivation et les réactions secondaires indésirables avec les électrodes/solvants. |
| Conductivité ionique | Détermine l'efficacité du flux de courant à l'intérieur de la cellule. |
| Pureté des réactifs | Des impuretés traces peuvent catalyser des réactions secondaires et fausser les résultats. |
Vous rencontrez des résultats électrochimiques incohérents ? Le bon électrolyte est la clé. KINTEK est spécialisé dans les réactifs et consommables de laboratoire de haute pureté, fournissant les électrolytes fiables et le soutien expert dont votre laboratoire a besoin pour garantir la précision et l'efficacité expérimentales.
Laissez nos experts vous aider à sélectionner l'électrolyte parfait pour votre application.
Contactez KINTEK dès aujourd'hui pour une consultation afin de discuter de vos besoins spécifiques et d'améliorer les performances de votre laboratoire.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique super scellée
- Bain-marie électrochimique multifonctionnel pour cellule électrolytique, simple ou double couche
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Potentiostat de poste de travail électrochimique de laboratoire pour une utilisation en laboratoire
- Membrane échangeuse de protons pour applications de laboratoire de batteries
Les gens demandent aussi
- Comment connecter la cellule électrolytique de type H ? Guide d'installation expert pour des expériences électrochimiques précises
- Quelle est la précaution concernant la température lors de l'utilisation d'une cellule électrolytique entièrement en PTFE ? Conseils essentiels de sécurité thermique
- Quels sont les avantages d'une cellule électrolytique en verre recouverte de PTFE ? Assurer la précision des tests saturés en CO2
- De quel matériau est fait le corps de la cellule d'électrolyse ? Verre borosilicaté de haute qualité pour une électrochimie fiable
- Quels sont les conseils généraux de manipulation pour une cellule d'électrolyse en verre ? Assurer des résultats électrochimiques précis















