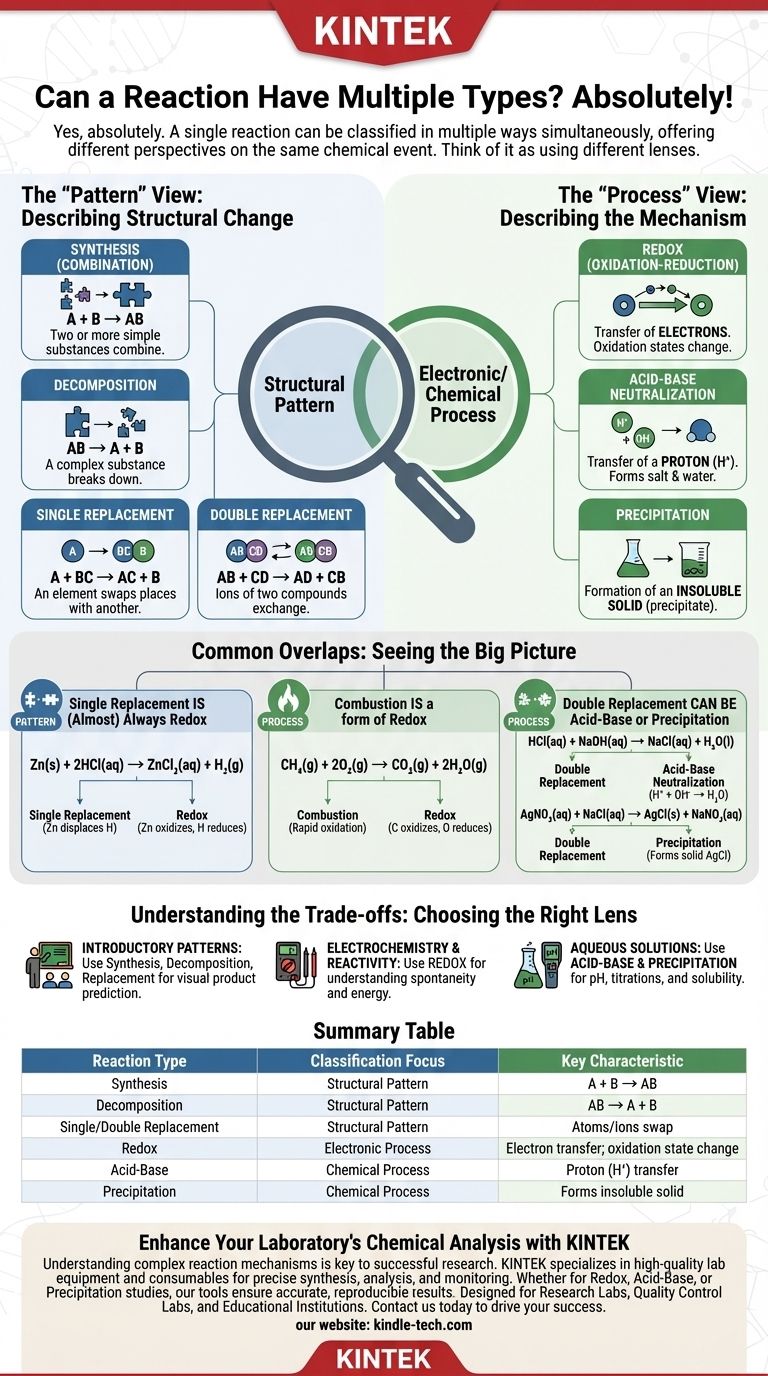
Oui, absolument. Une seule réaction chimique peut souvent être classée simultanément dans plusieurs types de réactions. C'est un point de confusion courant car la chimie d'introduction présente souvent les types de réactions comme des catégories mutuellement exclusives, mais une compréhension plus avancée révèle qu'il s'agit simplement de différentes lentilles pour analyser le même événement chimique.
La clé est de comprendre que certains types de réactions décrivent le modèle structurel de la façon dont les atomes se réorganisent (comme la synthèse ou la décomposition), tandis que d'autres décrivent le processus électronique ou chimique sous-jacent (comme la rédox ou l'acide-base). Une seule réaction peut présenter à la fois un modèle spécifique et un processus spécifique.

Pourquoi les étiquettes simples ne suffisent pas
La façon dont nous classons les réactions dépend de ce que nous voulons en comprendre. Les catégories simples apprises en premier sont utiles pour reconnaître les modèles visuels, mais elles n'expliquent pas toujours le changement chimique fondamental.
La vue "Modèle" : Décrire le changement structurel
Au début de votre formation en chimie, vous apprenez à reconnaître les réactions par la façon dont les réactifs forment les produits. Ces catégories décrivent la "forme" globale de la transformation.
Les principaux types basés sur les modèles sont :
- Synthèse (ou Combinaison) : Deux ou plusieurs substances simples se combinent pour former un produit plus complexe (
A + B → AB). - Décomposition : Une substance complexe se décompose en substances plus simples (
AB → A + B). - Substitution simple : Un élément prend la place d'un autre dans un composé (
A + BC → AC + B). - Substitution double : Les ions de deux composés échangent leurs places pour former deux nouveaux composés (
AB + CD → AD + CB).
Ces étiquettes sont excellentes pour prédire rapidement les produits en se basant sur un modèle familier.
La vue "Processus" : Décrire le mécanisme
Des classifications plus sophistiquées décrivent comment la transformation se produit au niveau moléculaire ou électronique. Elles se concentrent sur le processus fondamental qui motive la réaction.
Les principaux types basés sur les processus comprennent :
- Rédox (Oxydo-réduction) : Ce type implique le transfert d'électrons. Les états d'oxydation d'un ou plusieurs éléments changent pendant la réaction.
- Neutralisation acide-base : Un acide et une base réagissent, impliquant généralement le transfert d'un proton (ion H⁺) pour former un sel et de l'eau.
- Précipitation : Deux solutions aqueuses sont mélangées, et un solide insoluble (un précipité) est formé.
Ces étiquettes sont essentielles pour comprendre les forces motrices sous-jacentes d'une réaction.
Chevauchements courants que vous rencontrerez
Voir comment ces catégories se chevauchent est le meilleur moyen de consolider votre compréhension. La plupart des réactions que vous rencontrerez auront plus d'une étiquette valide.
La substitution simple est (presque) toujours une réaction rédox
Considérons la réaction du zinc métallique avec l'acide chlorhydrique :
Zn(s) + 2HCl(aq) → ZnCl₂(aq) + H₂(g)
C'est une réaction de substitution simple classique car le zinc déplace l'hydrogène. Cependant, c'est aussi une réaction rédox car les états d'oxydation changent : le zinc est oxydé (0 à +2) et l'hydrogène est réduit (+1 à 0).
La combustion est une forme de rédox
La combustion du méthane est un bon exemple :
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
Bien que nous appelions cela la combustion, il s'agit aussi fondamentalement d'une réaction rédox. Le carbone est oxydé (-4 à +4) et l'oxygène est réduit (0 à -2).
La substitution double peut être acide-base ou précipitation
Considérons la neutralisation de l'acide chlorhydrique avec l'hydroxyde de sodium :
HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l)
C'est une réaction de substitution double ; Na⁺ et H⁺ échangent leurs places. Plus important encore, c'est l'exemple définitif d'une neutralisation acide-base.
De même, le mélange de nitrate d'argent et de chlorure de sodium :
AgNO₃(aq) + NaCl(aq) → AgCl(s) + NaNO₃(aq)
Cela correspond au modèle de substitution double, mais sa caractéristique la plus notable est la formation d'un solide, ce qui en fait une réaction de précipitation.
Comprendre les compromis : Le but de la classification
Choisir une étiquette ne consiste pas à trouver la seule "bonne" réponse. Il s'agit d'utiliser l'étiquette la plus descriptive et la plus utile pour votre objectif spécifique.
La limitation des modèles simples
Classer une réaction comme "substitution simple" vous dit ce qui est arrivé aux atomes, mais cela n'explique pas pourquoi cela s'est produit. Cela n'explique pas pourquoi le zinc réagit avec HCl mais pas le cuivre.
Le pouvoir des étiquettes mécanistiques
Identifier cette même réaction comme "rédox" fournit une compréhension beaucoup plus profonde. Cela vous permet d'utiliser des concepts tels que la série d'activité ou les potentiels d'électrode standard pour prédire si la réaction se produira spontanément et pour quantifier l'énergie impliquée. L'étiquette rédox explique le "pourquoi".
Faire le bon choix pour votre objectif
Utilisez la classification qui sert le mieux votre objectif. Le but n'est pas de trouver une étiquette unique et exclusive, mais d'appliquer celle qui est la plus pertinente.
- Si votre objectif principal est de reconnaître des modèles de base dans un cours d'introduction : Tenez-vous-en à la synthèse, à la décomposition et aux substitutions simples/doubles pour prédire visuellement les produits.
- Si votre objectif principal est l'électrochimie ou la prédiction de la réactivité : La classification rédox est la lentille la plus importante à utiliser.
- Si votre objectif principal est de travailler avec des solutions aqueuses, le pH et les titrages : Classer les réactions comme acide-base ou précipitation sera l'approche la plus utile.
En fin de compte, l'utilisation de la bonne étiquette dépend de la question spécifique à laquelle vous essayez de répondre concernant la transformation chimique.
Tableau récapitulatif :
| Type de réaction | Objectif de la classification | Caractéristique clé |
|---|---|---|
| Synthèse | Modèle structurel | Deux réactifs ou plus se combinent en un seul produit (A + B → AB) |
| Décomposition | Modèle structurel | Un composé se décompose en substances plus simples (AB → A + B) |
| Substitution simple/double | Modèle structurel | Les atomes ou les ions s'échangent entre les composés |
| Rédox | Processus électronique | Implique le transfert d'électrons ; les états d'oxydation changent |
| Acide-Base | Processus chimique | Implique le transfert de proton (H⁺) |
| Précipitation | Processus chimique | Formation d'un solide insoluble à partir de solutions aqueuses |
Améliorez l'analyse chimique de votre laboratoire avec KINTEK
Comprendre les mécanismes de réaction complexes est essentiel pour la recherche et le développement réussis. Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire et de consommables de haute qualité qui soutiennent la synthèse chimique précise, l'analyse et la surveillance des processus. Que vous travailliez sur des réactions rédox, des titrages acide-base ou des études de précipitation, nos outils fiables vous aident à obtenir des résultats précis et reproductibles.
Nos produits sont conçus pour :
- Les Laboratoires de recherche nécessitant un contrôle précis de la température pour les réactions de synthèse et de décomposition.
- Les Laboratoires de contrôle qualité ayant besoin d'équipements cohérents pour les analyses acide-base et de précipitation.
- Les Établissements d'enseignement recherchant des appareils durables et faciles à utiliser pour l'enseignement des types de réactions fondamentaux et avancés.
Laissez KINTEK être votre partenaire de confiance pour faire progresser les capacités de votre laboratoire. Contactez-nous dès aujourd'hui pour discuter de vos besoins spécifiques et découvrir comment nos solutions peuvent vous aider à réussir.
Guide Visuel
Produits associés
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Réacteur Autoclave Haute Pression en Acier Inoxydable pour Laboratoire
- Réacteurs haute pression personnalisables pour des applications scientifiques et industrielles avancées
- Bain-marie thermoplongeur chauffant à température constante pour bain de réaction
- Broyeur hybride de laboratoire pour tissus
Les gens demandent aussi
- Quelle est la valeur technique d'une étuve de laboratoire dans la carbonisation des déchets solides ? Assurer l'intégrité des matériaux
- Quels sont les avantages de la pulvérisation cathodique magnétron DC ? Dépôt de couches minces à haute vitesse et de haute qualité
- Que fait un évaporateur rotatif sous vide ? Élimine en douceur les solvants pour une concentration précise des échantillons
- Le bromure de potassium est-il nocif pour l'environnement ? Découverte du risque caché pour la qualité de l'eau
- Pourquoi les ports de purge et d'évent sont-ils nécessaires pour les réservoirs d'échantillons dans les systèmes de simulation de produits de fission ? Assurer l'exactitude des données
- Quel est le processus de frittage des poudres ? Un guide complet pour la fabrication de pièces métalliques et céramiques
- Quelles technologies intelligentes sont intégrées dans les congélateurs ULT modernes ? Surveillance proactive et efficacité basée sur l'IA
- Quelles sont les limites de la pulvérisation cathodique magnétron ? Compromis clés dans le dépôt de couches minces






