Pour les applications de laboratoire, le corps d'une cellule d'électrolyse est généralement construit en verre borosilicaté de haute qualité, souvent avec une épaisseur de paroi d'environ 4,5 à 5 mm. Ce matériau est choisi pour son inertie chimique et sa résistance thermique. Le conteneur physique n'est cependant qu'une partie d'un système plus vaste conçu pour provoquer une réaction chimique à l'aide de l'électricité.
Le corps de la cellule est simplement un conteneur inerte. La véritable fonction d'une cellule électrolytique est définie par ses trois composants internes essentiels : deux électrodes (anode et cathode), un électrolyte contenant des ions mobiles et une source d'alimentation externe pour entraîner la réaction.

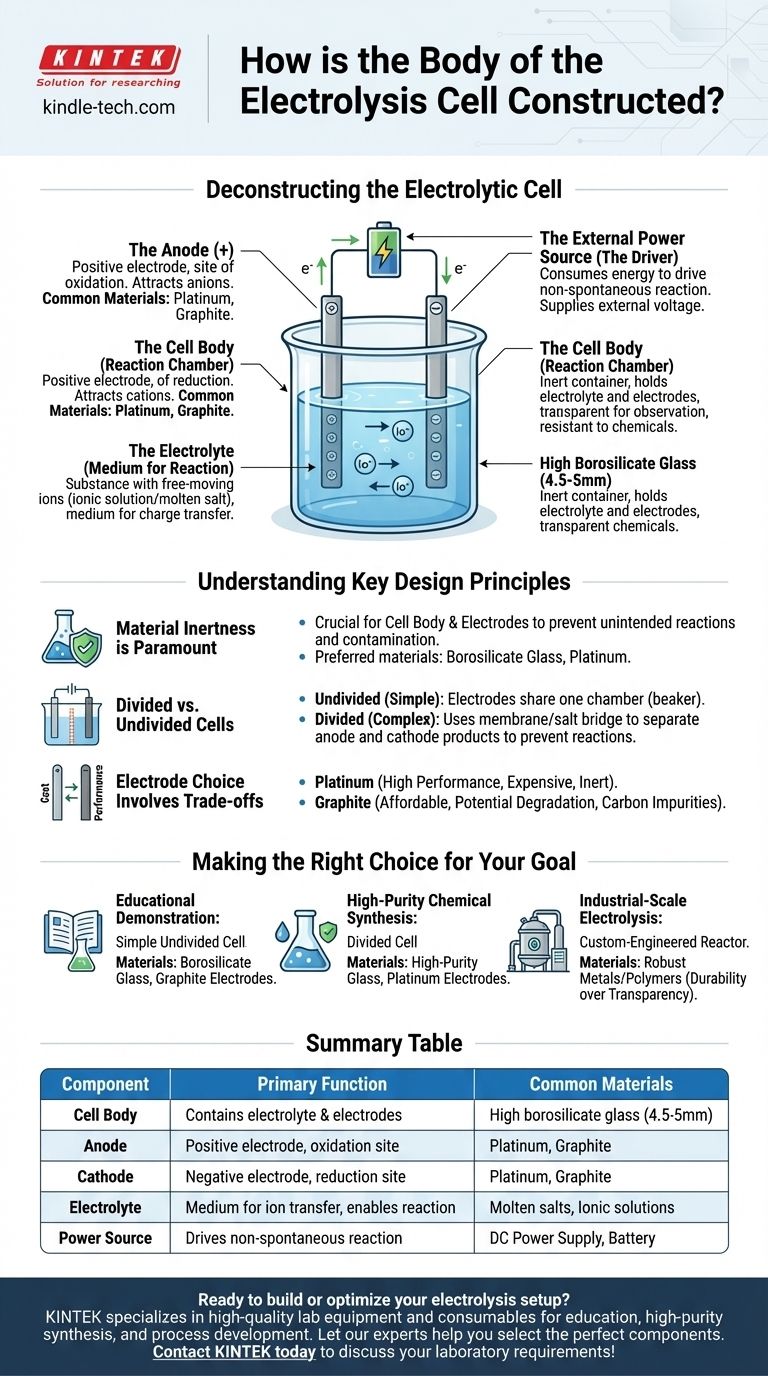
Déconstruction de la cellule électrolytique
Pour comprendre la construction de la cellule, vous devez regarder au-delà du récipient physique et analyser les composants fonctionnels qu'il abrite. Une cellule électrolytique est un système complet où chaque partie joue un rôle critique dans le processus d'électrolyse.
Le corps de la cellule (la chambre de réaction)
La fonction principale du corps est de contenir l'électrolyte et de maintenir les électrodes en place sans interférer avec la réaction chimique.
Le verre borosilicaté de haute qualité est un matériau courant car il est transparent, permettant l'observation, et très résistant à la corrosion des produits chimiques souvent agressifs utilisés comme électrolytes. Pour des applications spécifiques, d'autres matériaux inertes comme certains polymères peuvent être utilisés.
Les électrodes (l'anode et la cathode)
Les électrodes sont les conducteurs qui introduisent l'énergie électrique dans le système. Une cellule électrolytique en a toujours deux.
- L'anode est l'électrode positive. Elle attire les ions chargés négativement (anions) et est le lieu de l'oxydation.
- La cathode est l'électrode négative. Elle attire les ions chargés positivement (cations) et est le lieu de la réduction.
Celles-ci sont généralement fabriquées à partir de matériaux inertes, tels que le platine ou le graphite, qui conduisent bien l'électricité mais ne participent pas facilement à la réaction chimique eux-mêmes.
L'électrolyte (le milieu de réaction)
L'électrolyte est la substance qui contient des ions libres et remplit le corps de la cellule. C'est le milieu par lequel la charge est transférée entre les électrodes.
Les électrolytes peuvent être un composé ionique dissous dans un solvant (comme le sel dans l'eau) ou un composé ionique fondu (comme le chlorure de sodium fondu). Les ions spécifiques au sein de l'électrolyte sont ceux qui seront oxydés ou réduits pendant l'électrolyse.
La source d'alimentation externe (le moteur)
Contrairement à une batterie qui produit de l'énergie, une cellule électrolytique consomme de l'énergie pour forcer une réaction non spontanée à se produire.
Cette énergie est fournie par une source d'alimentation externe, telle qu'une batterie ou une alimentation CC, qui est connectée à l'anode et à la cathode. Cette tension externe est ce qui pousse les électrons à travers le circuit et entraîne les ions vers leurs électrodes respectives.
Comprendre les principes clés de conception
La construction d'une cellule électrolytique est guidée par des principes fondamentaux qui assurent son bon fonctionnement. Une mauvaise compréhension de ceux-ci peut entraîner des expériences ratées ou des processus inefficaces.
L'inertie des matériaux est primordiale
Le principe le plus important pour le corps de la cellule et les électrodes est l'inertie chimique. Le conteneur et les conducteurs électriques ne doivent pas réagir avec l'électrolyte. Toute réaction involontaire peut contaminer les produits et perturber le processus électrochimique souhaité. C'est pourquoi des matériaux spécialisés comme le verre borosilicaté et le platine sont préférés au verre standard ou aux métaux réactifs.
Cellules divisées ou non divisées
La conception de cellule la plus simple est une cellule "non divisée", où les deux électrodes partagent un électrolyte commun dans une seule chambre, comme un bécher.
Cependant, parfois les produits formés à l'anode et à la cathode peuvent réagir entre eux. Dans ces cas, une cellule "divisée" est utilisée. Cette conception intègre une membrane poreuse ou un pont salin pour séparer la cellule en deux demi-cellules distinctes, gardant les produits isolés tout en permettant aux ions de circuler entre les compartiments.
Le choix des électrodes implique des compromis
Bien que les deux soient courants, le choix entre les électrodes en platine et en graphite implique un compromis classique entre coût et performance.
Le platine est extrêmement inerte et efficace mais très coûteux. Le graphite est un conducteur beaucoup plus abordable mais peut se dégrader ou réagir dans certaines conditions, en particulier à des tensions élevées ou avec des électrolytes spécifiques, introduisant potentiellement des impuretés de carbone dans le système.
Faire le bon choix pour votre objectif
La construction optimale d'une cellule électrolytique dépend entièrement de son application prévue.
- Si votre objectif principal est la démonstration pédagogique : Un simple bécher non divisé en verre borosilicaté avec des électrodes en graphite peu coûteuses est parfaitement suffisant et rentable.
- Si votre objectif principal est la synthèse chimique de haute pureté : Une cellule divisée en verre de haute pureté avec des électrodes en platine stables et inertes est essentielle pour prévenir la contamination des produits et les réactions secondaires.
- Si votre objectif principal est l'électrolyse à l'échelle industrielle : La cellule sera un réacteur hautement spécialisé, conçu sur mesure, souvent construit à partir de métaux ou de polymères robustes conçus pour la durabilité, l'efficacité et le fonctionnement continu plutôt que la transparence.
Comprendre ces composants essentiels et leurs fonctions vous permet de sélectionner ou de concevoir une cellule qui correspond précisément à votre objectif.
Tableau récapitulatif :
| Composant | Fonction principale | Matériaux courants |
|---|---|---|
| Corps de la cellule | Contient l'électrolyte et les électrodes | Verre borosilicaté de haute qualité (4,5-5mm) |
| Anode | Électrode positive ; site d'oxydation | Platine, Graphite |
| Cathode | Électrode négative ; site de réduction | Platine, Graphite |
| Électrolyte | Milieu de transfert d'ions ; permet la réaction | Sels fondus, Solutions ioniques |
| Source d'alimentation | Entraîne la réaction non spontanée | Alimentation CC, Batterie |
Prêt à construire ou à optimiser votre installation d'électrolyse ? La bonne construction de cellule est essentielle pour le succès de votre laboratoire, que ce soit pour l'éducation, la synthèse de haute pureté ou le développement de processus. KINTEK est spécialisé dans la fourniture d'équipements de laboratoire et de consommables de haute qualité dont vous avez besoin – de la verrerie borosilicatée durable aux électrodes inertes en platine et en graphite. Laissez nos experts vous aider à sélectionner les composants parfaits pour votre application spécifique. Contactez KINTEK dès aujourd'hui pour discuter de vos besoins en laboratoire !
Guide Visuel
Produits associés
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellules d'électrolyse PEM personnalisables pour diverses applications de recherche
- Cellule électrolytique électrochimique à bain-marie double couche
Les gens demandent aussi
- Quelles sont les procédures après l'utilisation d'une cellule électrolytique à double couche à bain-marie ? Assurer la longévité de l'équipement et la précision des données
- Quand une réparation professionnelle est-elle requise pour une cellule électrolytique à bain-marie à double couche ? Protégez la précision et la sécurité de votre laboratoire
- Quels sont les volumes typiques et les configurations d'ouverture pour une cellule électrolytique à double couche à bain-marie ? Optimisez votre configuration électrochimique
- Quelles sont les caractéristiques clés de la cellule électrolytique à cinq ports à bain-marie ? Contrôle de précision pour les expériences électrochimiques
- Quelles sont les spécifications standard des ouvertures pour une cellule électrolytique ? Tailles clés pour votre montage électrochimique



















