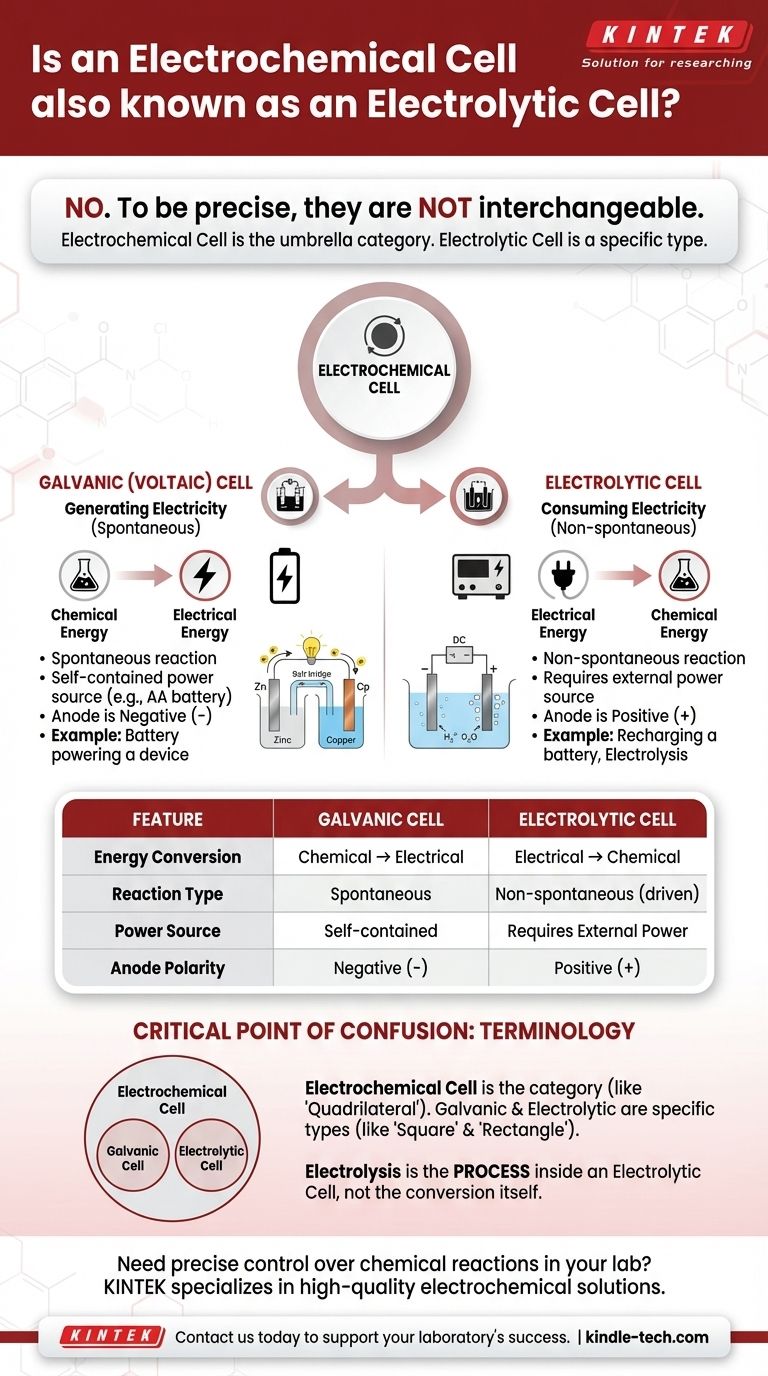
Pour être précis, non. Une cellule électrolytique est un type spécifique de cellule électrochimique, mais les deux termes ne sont pas interchangeables. "Cellule électrochimique" est la catégorie large et englobante pour tout dispositif qui convertit l'énergie chimique en énergie électrique ou vice versa. Les cellules électrolytiques sont le type qui utilise spécifiquement l'énergie électrique pour provoquer une réaction chimique.
La distinction fondamentale réside dans la direction de la conversion d'énergie. Une cellule galvanique (ou voltaïque) libère spontanément de l'énergie d'une réaction chimique pour créer de l'électricité. Une cellule électrolytique consomme de l'électricité provenant d'une source externe pour forcer une réaction chimique à se produire.

La distinction fondamentale : le flux d'énergie
Le but d'une cellule électrochimique dicte sa classification. La question principale à se poser est de savoir si la cellule produit de l'énergie ou en consomme.
Cellules galvaniques (voltaïques) : production d'électricité
Une cellule galvanique, également connue sous le nom de cellule voltaïque, exploite une réaction chimique spontanée.
Les réactifs à l'intérieur de la cellule ont une tendance naturelle à réagir, libérant de l'énergie au cours du processus. Cette énergie est capturée sous forme de courant électrique.
Pensez à une pile AA standard dans une télécommande. C'est une cellule galvanique, convertissant son énergie chimique interne en énergie électrique nécessaire pour alimenter la télécommande.
Cellules électrolytiques : consommation d'électricité
Une cellule électrolytique utilise une source externe d'énergie électrique (comme une alimentation électrique) pour entraîner une réaction chimique non spontanée.
Sans cette alimentation externe, la réaction chimique ne se produirait pas d'elle-même. L'électricité force la réaction à se dérouler contre sa tendance naturelle.
Un exemple courant est l'électrolyse, comme la séparation de l'eau en hydrogène et en oxygène gazeux. Un autre est la recharge d'une batterie lithium-ion ; vous utilisez de l'électricité pour inverser la réaction de décharge et restaurer son potentiel chimique.
Identificateurs clés pour chaque type de cellule
Au-delà de la direction du flux d'énergie, quelques caractéristiques techniques aident à différencier les deux types de cellules.
Le rôle d'une source d'alimentation externe
C'est l'indicateur le plus simple. Si un appareil est autonome et agit comme source d'alimentation, c'est une cellule galvanique.
Si l'appareil doit être branché à une source d'alimentation externe pour fonctionner, c'est une cellule électrolytique.
Polarité de l'anode et de la cathode
Bien que les définitions de l'anode (où se produit l'oxydation) et de la cathode (où se produit la réduction) restent constantes, leur charge électrique (polarité) s'inverse entre les deux types de cellules.
Dans une cellule galvanique, l'anode est la borne négative (-) et la cathode est la borne positive (+).
Dans une cellule électrolytique, la source d'alimentation externe inverse cela. L'anode devient la borne positive (+) et la cathode devient la borne négative (-).
Le point critique de confusion : la terminologie
La principale source de confusion provient de la nature à la fois chevauchante et distincte des termes. Ne pas les différencier conduit à des malentendus fondamentaux.
"Cellule électrochimique" est le terme générique
Considérez "cellule électrochimique" comme la catégorie générale, comme "quadrilatère".
Les cellules galvaniques et les cellules électrolytiques sont les types spécifiques au sein de cette catégorie, tout comme "carré" et "rectangle" sont des types spécifiques de quadrilatères. Une cellule électrolytique est toujours une cellule électrochimique, mais toutes les cellules électrochimiques ne sont pas électrolytiques.
L'utilisation abusive de "l'électrolyse"
L'électrolyse est le processus d'utilisation de l'électricité pour entraîner une réaction chimique. Ce processus a lieu à l'intérieur d'une cellule électrolytique.
Certaines définitions affirment à tort que l'électrolyse est la conversion de l'énergie chimique en énergie électrique. C'est le contraire de la vérité. L'électrolyse consiste fondamentalement à utiliser l'électricité pour créer un changement chimique.
Faire la bonne distinction pour votre objectif
Pour appliquer correctement ces connaissances, identifiez simplement la fonction principale de l'appareil que vous analysez.
- Si votre objectif est un appareil qui alimente quelque chose (une télécommande, un téléphone, une horloge) : Vous avez affaire à une cellule galvanique (voltaïque), qui convertit l'énergie chimique stockée en électricité.
- Si votre objectif est un processus qui utilise l'électricité pour créer une substance (recharger une batterie, plaquer du métal, produire du chlore gazeux) : Vous avez affaire à une cellule électrolytique, qui utilise l'énergie électrique pour forcer un changement chimique.
- Si vous décrivez le domaine général ou un appareil à double capacité (comme une batterie rechargeable) : Le terme "cellule électrochimique" est le choix correct et le plus inclusif.
Comprendre la direction de la conversion d'énergie est la clé pour maîtriser ce concept fondamental en chimie et en ingénierie.
Tableau récapitulatif :
| Caractéristique | Cellule galvanique (voltaïque) | Cellule électrolytique |
|---|---|---|
| Conversion d'énergie | Chimique → Électrique | Électrique → Chimique |
| Type de réaction | Spontanée | Non spontanée (forcée) |
| Source d'alimentation | Autonome (ex. pile) | Nécessite une alimentation externe |
| Polarité de l'anode | Borne négative (-) | Borne positive (+) |
| Exemple courant | Pile AA dans une télécommande | Recharge d'une batterie lithium-ion |
Besoin d'un contrôle précis sur les réactions chimiques dans votre laboratoire ? Comprendre le bon type de cellule électrochimique est crucial pour votre recherche et vos processus. Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire et de consommables de haute qualité adaptés à vos besoins électrochimiques spécifiques. Que vous travailliez avec des cellules galvaniques pour la production d'énergie ou des cellules électrolytiques pour la synthèse, nos solutions garantissent précision et fiabilité. Contactez-nous dès aujourd'hui pour discuter de la manière dont nous pouvons soutenir le succès de votre laboratoire !
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Quelle est la fonction d'une cellule électrolytique à trois électrodes ? Améliorer la précision de l'EIS pour l'évaluation des revêtements en polyester
- Qu'est-ce qu'une cellule électrolytique optique à fenêtre latérale ? Voir vos réactions électrochimiques en action
- Quels sont les risques d'un contrôle de tension inapproprié dans une cellule d'électrolyse ? Évitez les dommages coûteux et l'inefficacité
- Comment nettoyer la cellule électrolytique de type H après utilisation ? Maintenance experte pour des résultats électrochimiques purs
- Quelles sont les procédures et les observations nécessaires lors d'une expérience avec une cellule électrolytique à plaque plane pour la corrosion ? Maîtriser la méthode en 3 phases
- Comment le transport des ions est-il contrôlé dans la cellule électrolytique ? Maîtriser la sélectivité et l'efficacité
- Quelles sont les principales consignes de sécurité pour l'utilisation de la cellule électrolytique ? Protocoles essentiels pour la sécurité en laboratoire
- Comment les produits et le liquide résiduel doivent-ils être manipulés après une expérience ? Assurer la sécurité et la conformité du laboratoire



















