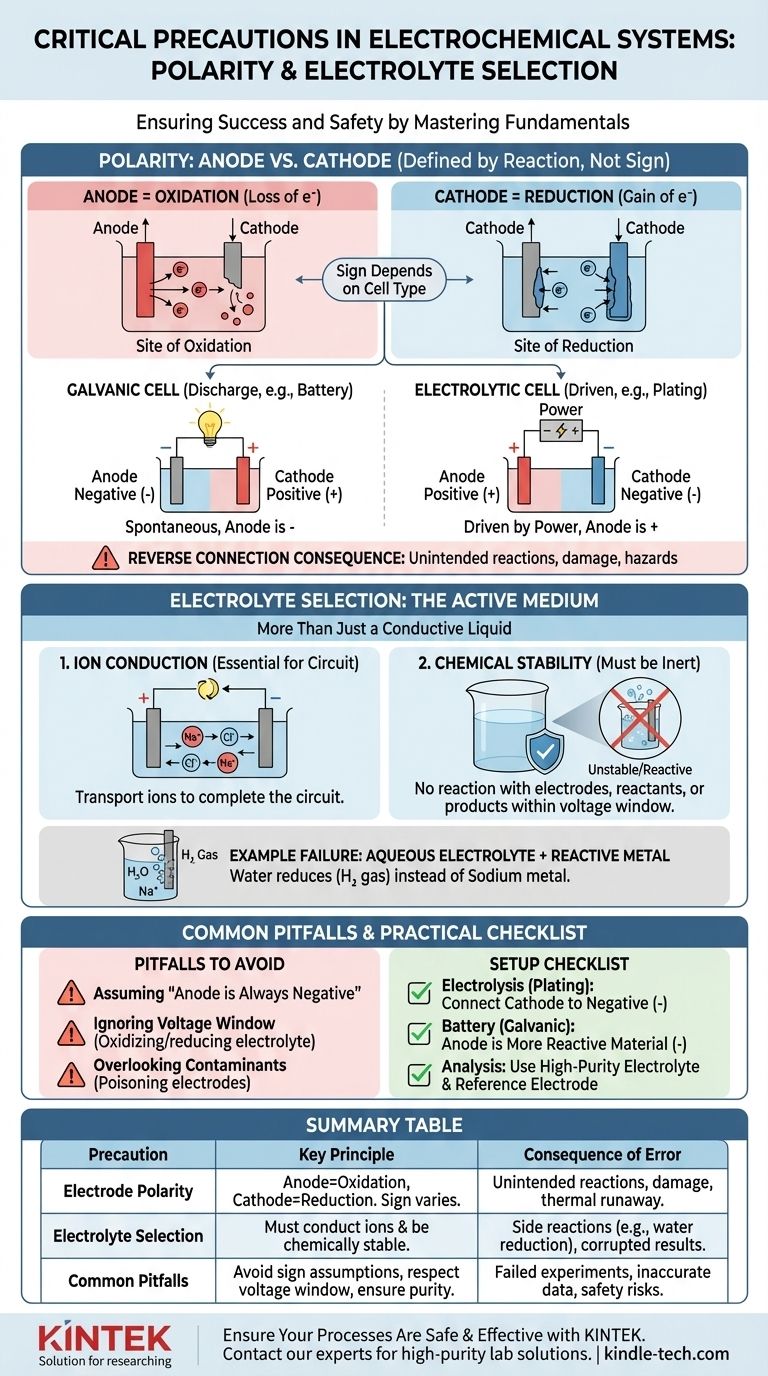
Dans tout système électrochimique, les deux précautions les plus critiques sont d'assurer la polarité correcte des électrodes et de sélectionner l'électrolyte approprié pour votre réaction. La polarité dicte quel processus chimique se produit où, tandis que l'électrolyte fournit le milieu nécessaire à ce processus. Une erreur dans l'un ou l'autre peut entraîner des expériences ratées, des équipements endommagés ou des risques de sécurité importants.
La polarité de vos électrodes définit la direction de la réaction chimique, et l'électrolyte détermine sa faisabilité. Un désaccord dans l'un ou l'autre modifiera fondamentalement, inhibera ou corrompra activement le processus électrochimique visé.
Le rôle critique de la polarité : Anode contre Cathode
Identifier correctement votre anode et votre cathode est la première étape pour construire une cellule électrochimique fonctionnelle et prévisible. Cela va au-delà de la simple étiquetage des bornes comme « positif » ou « négatif ».
Ce que signifie réellement la « Polarité »
Les termes anode et cathode sont définis par le type de réaction, et non par leur charge.
- L'Anode est toujours le site de l'Oxydation (perte d'électrons).
- La Cathode est toujours le site de la Réduction (gain d'électrons).
La confusion survient car le signe (+ ou -) de ces électrodes dépend du type de cellule. Lors de la décharge d'une batterie (cellule galvanique), l'anode est la borne négative. Lors d'une configuration d'électrolyse (cellule électrolytique), l'anode est connectée à la borne positive de l'alimentation électrique.
La conséquence d'une connexion inversée
Connecter les électrodes incorrectement force les réactions chimiques à s'exécuter dans le sens inverse ou d'une manière non prévue.
Dans une cellule électrolytique (par exemple, le placage électrolytique), une connexion inversée signifie que vous retirerez du matériau de l'électrode que vous vouliez plaquer et déposerez du matériau sur votre anode source, détruisant les deux.
Dans une batterie rechargeable, la charger avec une polarité inversée peut provoquer des dommages irréversibles aux structures des électrodes, entraînant une perte de capacité permanente, des courts-circuits internes et potentiellement un emballement thermique dangereux.
Sélection de l'électrolyte : Plus qu'un simple liquide conducteur
L'électrolyte n'est pas un composant passif ; c'est une partie active et critique du système électrochimique. Ses propriétés dictent quelles réactions sont même possibles.
La fonction principale : Conduction ionique
Le rôle le plus basique de l'électrolyte est de transporter les ions entre l'anode et la cathode, complétant ainsi le circuit électrique. Sans milieu pour le flux d'ions, toute la réaction s'arrêterait instantanément.
La fonction critique : Stabilité chimique
L'électrolyte et son solvant doivent être chimiquement inertes dans les conditions de fonctionnement. Ils ne doivent pas réagir avec les électrodes, les réactifs ou les produits de votre réaction principale. C'est la source des « réactions secondaires indésirables » mentionnées dans les protocoles de sécurité.
Exemple : Pourquoi les électrolytes aqueux échouent pour les métaux réactifs
Imaginez essayer de produire du sodium métallique en électrolysant une solution de chlorure de sodium (NaCl) dans l'eau.
Vous pourriez vous attendre à ce que les ions sodium (Na+) se déplacent vers la cathode, gagnent un électron et forment du sodium métallique. Cependant, l'eau (H₂O) est également présente et est beaucoup plus facile à réduire que les ions sodium. Par conséquent, vous produirez de l'hydrogène gazeux à la cathode, et aucun sodium métallique ne se formera. Le choix de l'électrolyte a rendu la réaction souhaitée impossible.
Comprendre les compromis et les pièges courants
Éviter les erreurs simples nécessite de comprendre les principes fondamentaux qui régissent toutes les cellules électrochimiques.
Piège 1 : Supposer que « l'anode est négative »
L'erreur la plus courante est d'identifier de manière erronée l'anode et la cathode. N'oubliez jamais de les définir par la réaction (oxydation/réduction), et non par un signe fixe. Déterminez si votre cellule est galvanique (spontanée) ou électrolytique (alimentée par une source externe) pour attribuer le signe correct.
Piège 2 : Ignorer la fenêtre de tension de l'électrolyte
Chaque électrolyte possède une fenêtre de potentiel de stabilité. Si vous appliquez une tension qui dépasse cette fenêtre, vous commencerez à oxyder ou à réduire l'électrolyte lui-même, et non votre cible prévue. Cela consomme de l'énergie, crée des impuretés et arrête la réaction souhaitée.
Piège 3 : Négliger les contaminants
Même des traces d'impuretés dans un électrolyte peuvent avoir un impact énorme. Les contaminants peuvent se déposer sur la surface d'une électrode, l'« empoisonner » et empêcher la réaction prévue, ou ils peuvent agir comme catalyseurs pour des réactions secondaires indésirables qui corrompent vos résultats.
Une liste de contrôle pratique pour votre installation
Utilisez ces directives pour vous assurer que votre configuration expérimentale est correcte dès le départ.
- Si votre objectif principal est l'électrolyse (par exemple, le placage, le raffinage) : Connectez l'électrode que vous souhaitez plaquer (la cathode) à la borne négative de l'alimentation et le matériau source (l'anode) à la borne positive.
- Si votre objectif principal est de construire une batterie (une cellule galvanique) : Le matériau le plus chimiquement réactif qui est oxydé est votre anode (borne négative), et le matériau le moins réactif est votre cathode (borne positive).
- Si votre objectif principal est une analyse électrochimique précise : Utilisez un électrolyte de haute pureté, souvent dégazé, pour éviter les réactions secondaires, et confirmez votre configuration de polarité par rapport à une norme connue ou une électrode de référence.
En traitant le choix de la polarité et de l'électrolyte comme des paramètres de conception fondamentaux, vous passez de la simple exécution d'instructions à la véritable ingénierie du résultat électrochimique souhaité.

Tableau récapitulatif :
| Précaution | Principe clé | Conséquence de l'erreur |
|---|---|---|
| Polarité des électrodes | Anode = site d'oxydation ; Cathode = site de réduction. Le signe dépend du type de cellule (galvanique vs électrolytique). | Une connexion inversée provoque des réactions non désirées (par exemple, arrachement au lieu de placage), des dommages matériels ou un emballement thermique. |
| Sélection de l'électrolyte | Doit conduire les ions et rester chimiquement stable dans les conditions de fonctionnement (fenêtre de tension). | Un mauvais électrolyte permet des réactions secondaires (par exemple, réduction de l'eau au lieu du dépôt de sodium), corrompt les résultats et gaspille de l'énergie. |
| Pièges courants | Supposer que « l'anode est toujours négative » ; ignorer la fenêtre de tension de l'électrolyte ; négliger les contaminants. | Expériences ratées, données inexactes et risques de sécurité dus à des processus chimiques non intentionnels. |
Assurez la sécurité et l'efficacité de vos processus électrochimiques avec KINTEK
Vous mettez en place un projet d'électrolyse, de placage ou de développement de batteries ? Une polarité d'électrode et une sélection d'électrolyte appropriées sont non négociables pour obtenir des résultats précis et maintenir la sécurité. Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire et de consommables de haute pureté — y compris des cellules électrochimiques, des électrolytes purs et des alimentations fiables — pour soutenir les besoins uniques de votre laboratoire.
Laissez-nous vous aider à éviter des erreurs coûteuses et des dangers. Contactez nos experts dès aujourd'hui pour discuter de votre application spécifique et découvrir comment les solutions de KINTEK peuvent améliorer votre flux de travail électrochimique.
Guide Visuel
Produits associés
- Électrode à disque de platine rotatif pour applications électrochimiques
- Électrode à disque d'or
- Électrode de référence au sulfate de cuivre pour usage en laboratoire
- Électrode auxiliaire en platine pour usage en laboratoire
- Onglets nickel-aluminium pour batteries au lithium souples
Les gens demandent aussi
- Quelles sont les caractéristiques de performance des électrodes en fil/tige de platine ? Une stabilité inégalée pour votre laboratoire
- Quelle est la différence entre RDE et RRDE ? Débloquez l'analyse électrochimique avancée des réactions
- Quelle est une application courante pour l'électrode en fil/tige de platine ? Le guide essentiel des contre-électrodes
- Qu'est-ce que la méthode de l'électrode à disque rotatif et annulaire ? Débloquez l'analyse des réactions en temps réel
- Quelle est l'application de l'RRDE ? Découvrez des informations quantitatives sur les catalyseurs et les réactions



















