À la base, la corrosion est la dégradation naturelle d'un métal raffiné en une forme chimiquement plus stable, telle que son oxyde ou son sulfure. Au sein d'une cellule électrochimique, ce processus n'est pas simplement une réaction de surface, mais un circuit complet où le métal s'autodétruit en créant une minuscule batterie indésirable sur sa propre surface.
La corrosion est un processus électrochimique car elle implique les quatre composants essentiels d'une batterie : une anode (où le métal est perdu), une cathode, un électrolyte (comme l'eau) et un chemin métallique, tous travaillant ensemble pour décomposer le métal.
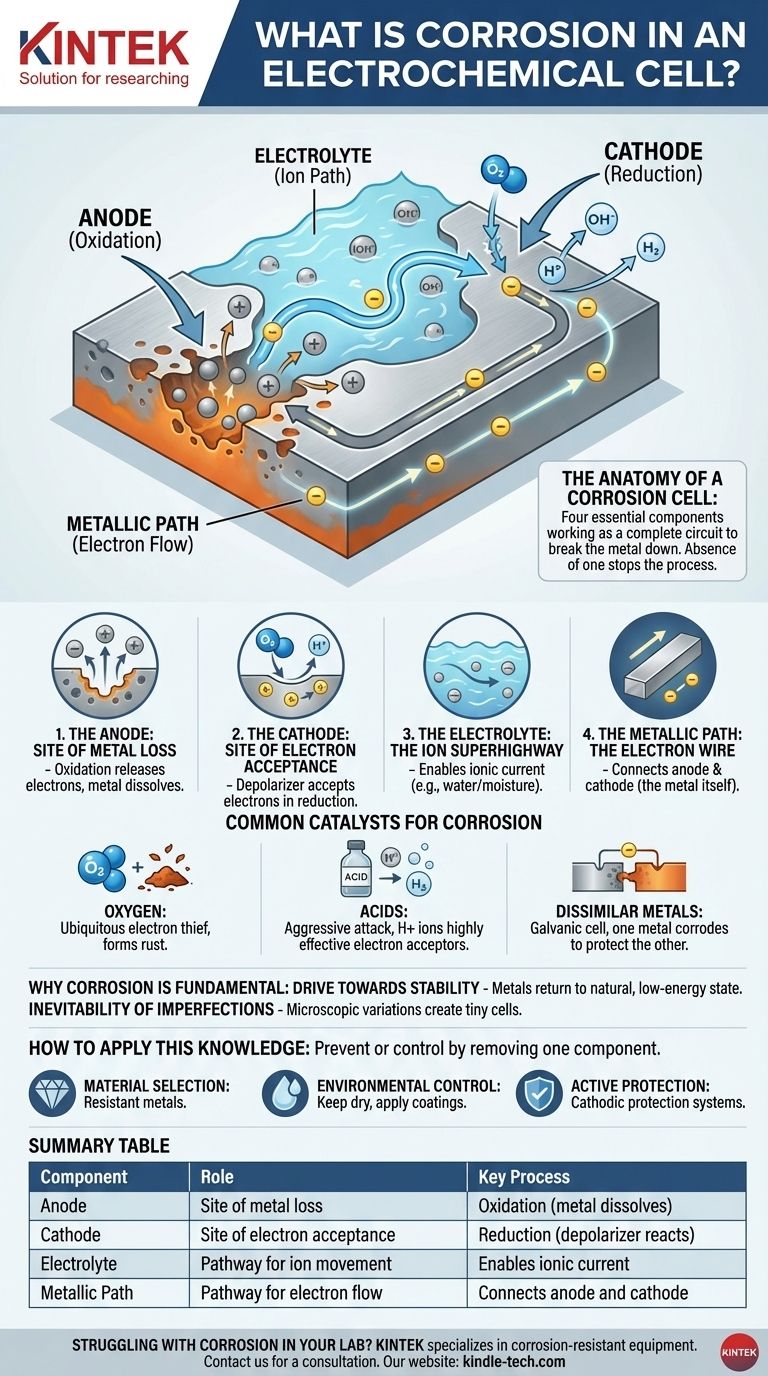
L'anatomie d'une cellule de corrosion
Comprendre la corrosion, c'est comprendre les quatre composants dont elle a besoin pour fonctionner. L'absence de l'un de ces composants arrêtera complètement le processus.
L'anode : le site de la perte de métal
Le site anodique est le point spécifique sur la surface du métal où la corrosion se produit. Ici, les atomes de métal subissent une oxydation, perdant des électrons et se transformant en ions chargés positivement qui se dissolvent dans l'eau ou l'humidité environnante. C'est l'acte physique du métal qui est rongé.
La cathode : le site d'acceptation des électrons
Les électrons libérés par l'anode voyagent à travers le métal vers un autre endroit, le site cathodique. Ici, une substance dans l'environnement — connue sous le nom de dépolariseur — accepte ces électrons dans une réaction de réduction. Ce dépolariseur est un ingrédient essentiel.
L'électrolyte : la super-autoroute des ions
L'eau, même en quantités microscopiques comme l'humidité, agit comme électrolyte. Elle fournit un milieu pour que les ions métalliques dissous (provenant de l'anode) et d'autres ions voyagent, complétant le circuit électrique. Sans électrolyte, les ions n'ont aucun moyen de se déplacer, et le circuit est rompu.
Le chemin métallique : le fil d'électrons
Le corps du métal lui-même sert de chemin métallique. Il fournit une voie conductrice pour que les électrons voyagent de l'anode à la cathode. C'est pourquoi les sites anodiques et cathodiques peuvent être juste à côté l'un de l'autre ou éloignés sur la même pièce de métal.
Catalyseurs courants de la corrosion
Le taux et la gravité de la corrosion sont souvent dictés par la disponibilité et le type de dépolariseur (l'accepteur d'électrons) à la cathode.
L'oxygène : le voleur d'électrons omniprésent
Dans la plupart des environnements courants, l'oxygène dissous est le principal accepteur d'électrons. C'est pourquoi l'eau et l'oxygène ensemble sont si destructeurs pour les métaux comme le fer, conduisant à la formation de rouille (oxyde de fer).
Les acides : une attaque agressive
Les acides accélèrent considérablement la corrosion. Les ions hydrogène (H+) dans une solution acide sont des accepteurs d'électrons très efficaces, créant de l'hydrogène gazeux à la cathode. Ce processus est généralement beaucoup plus rapide et plus agressif que la corrosion due à l'oxygène.
Métaux dissemblables : la pile galvanique
Lorsque deux métaux différents sont en contact électrique au sein d'un électrolyte, ils créent une pile galvanique. Le métal moins noble et plus actif deviendra l'anode et se corrodera rapidement, tandis que le métal plus noble deviendra la cathode et sera protégé. C'est pourquoi vous voyez des anodes sacrificielles en zinc sur les coques de bateaux pour protéger l'acier.
Pourquoi la corrosion est un processus fondamental
La corrosion n'est pas un défaut ; c'est un processus naturel et spontané régi par les lois fondamentales de la thermodynamique. Comprendre cette inévitabilité est essentiel pour la gérer.
La quête de stabilité
Les métaux raffinés comme l'aluminium et l'acier sont des matériaux fabriqués par l'homme maintenus dans un état de haute énergie. La corrosion est simplement le processus par lequel ce métal retourne à son état naturel de basse énergie, similaire au minerai dont il a été extrait. Le métal libère son énergie stockée.
L'inévitabilité des imperfections
Aucune surface métallique n'est parfaitement uniforme. Des variations microscopiques de composition, des contraintes de fabrication ou même des différences d'exposition à l'oxygène créent de minuscules sites anodiques et cathodiques sur toute la surface. Ces imperfections sont tout ce qu'il faut pour initier des milliers de cellules de corrosion microscopiques.
Comment appliquer ces connaissances
Comprendre que la corrosion est une cellule électrochimique vous donne un cadre clair pour la prévenir ou la contrôler. La stratégie consiste toujours à supprimer l'un des quatre composants essentiels.
- Si votre objectif principal est le choix des matériaux : Utilisez des métaux naturellement résistants à la formation d'une cellule électrochimique dans leur environnement de service, ou évitez de connecter des métaux dissemblables.
- Si votre objectif principal est le contrôle environnemental : Éliminez l'électrolyte en gardant le métal sec ou en appliquant un revêtement imperméable (comme de la peinture) pour empêcher l'humidité d'atteindre la surface.
- Si votre objectif principal est la protection active : Créez intentionnellement une cellule électrochimique plus puissante où votre métal structurel est forcé d'être la cathode. C'est le principe derrière les anodes sacrificielles et les systèmes de protection cathodique.
En considérant la corrosion comme un simple circuit, vous pouvez systématiquement diagnostiquer sa cause et interrompre efficacement son chemin destructeur.

Tableau récapitulatif :
| Composant | Rôle dans la cellule de corrosion | Processus clé |
|---|---|---|
| Anode | Site de perte de métal | Oxydation (le métal se dissout) |
| Cathode | Site d'acceptation des électrons | Réduction (le dépolariseur réagit) |
| Électrolyte | Chemin pour le mouvement des ions | Permet le courant ionique (ex. : eau) |
| Chemin métallique | Chemin pour le flux d'électrons | Connecte l'anode et la cathode (le métal lui-même) |
Vous rencontrez des problèmes de corrosion dans votre équipement de laboratoire ?
La corrosion peut compromettre vos expériences, endommager les instruments sensibles et entraîner des temps d'arrêt coûteux. KINTEK est spécialisé dans les équipements et consommables de laboratoire résistants à la corrosion, vous aidant à protéger vos investissements et à garantir l'intégrité de votre recherche.
Nos experts peuvent vous aider à sélectionner les bons matériaux et solutions pour interrompre le circuit de corrosion dans votre environnement de laboratoire spécifique.
Contactez KINTEK dès aujourd'hui pour une consultation et découvrez comment nous pouvons vous aider à combattre la corrosion et à améliorer les performances de votre laboratoire.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique de corrosion plane
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique à électrolyse spectrale en couche mince
Les gens demandent aussi
- Quels types d'électrodes sont utilisés dans une cellule électrolytique de type H ? Un guide du système essentiel à trois électrodes
- Qu'est-ce qui est important concernant le contrôle de la température pour la cellule électrolytique de type H ? Assurer la précision et l'intégrité des données
- Quel rôle le système électrolytique joue-t-il dans les pré-revêtements Ni/Al2O3 + TiO2 ? Optimisez votre traitement de surface Ti-6Al-4V
- Quel rôle jouent les réacteurs cylindriques en verre borosilicaté de qualité laboratoire ? Améliorez votre recherche sur l'électro-oxydation
- Quelles sont les configurations d'ouverture standard pour les cellules électrolytiques entièrement en PTFE non scellées et scellées ?
- Quelle est la nécessité d'utiliser la Zircone Stabilisée à l'Yttria (YSZ) comme électrolyte solide dans les SOEC ? Optimisez l'électrolyse de la vapeur à haut rendement
- Qu'est-ce que la méthode d'électrolyse pour le traitement de l'eau ? Un guide de la purification électrochimique
- Quelles sont les fonctions spécifiques des cellules électrochimiques spécialisées pour l'ATR-SEIRAS in-situ ? Déverrouiller les voies de réaction



















