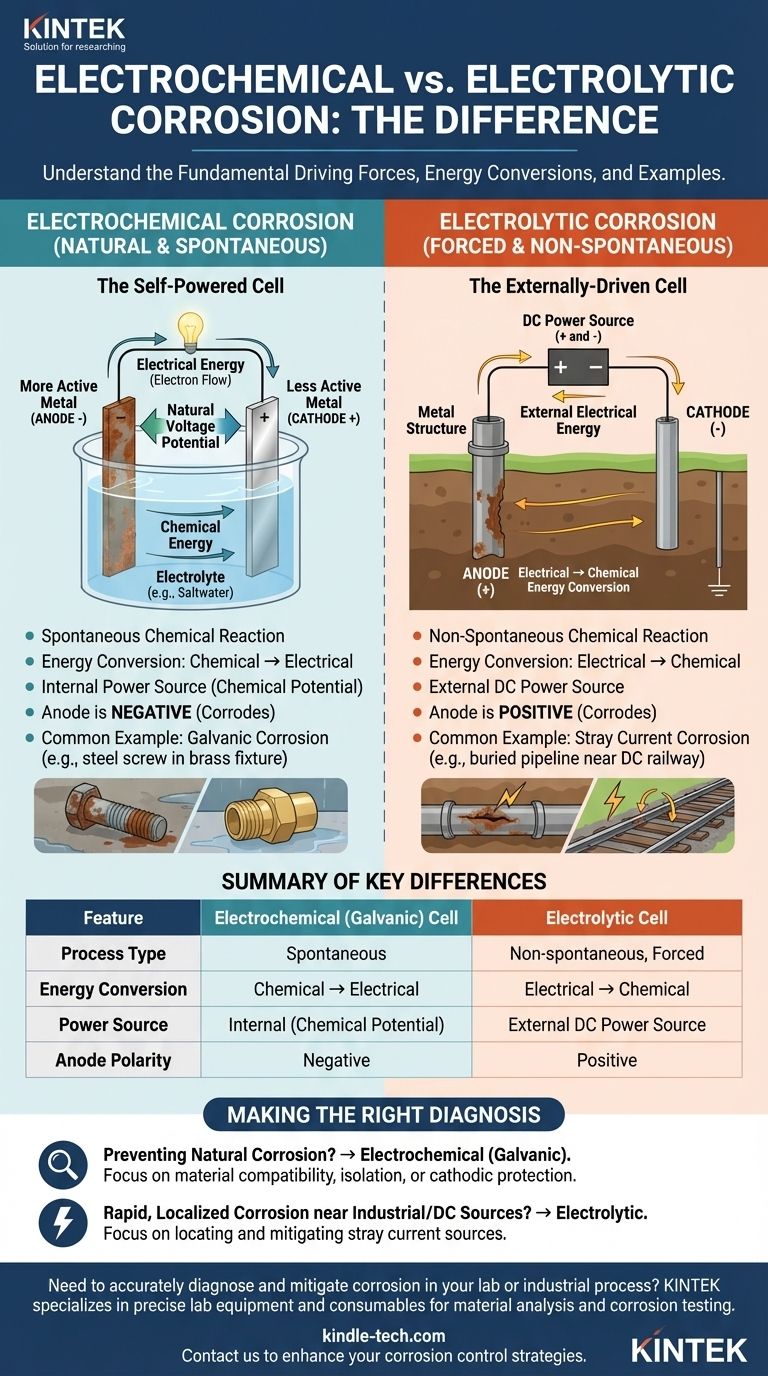
Au niveau fondamental, la différence entre une cellule de corrosion électrolytique et une cellule de corrosion électrochimique réside dans leur conversion d'énergie et leur force motrice. Une cellule électrochimique est un processus spontané qui convertit l'énergie chimique stockée en énergie électrique, provoquant une corrosion naturelle. En revanche, une cellule électrolytique est un processus non spontané qui utilise de l'énergie électrique externe pour forcer une réaction chimique, provoquant une corrosion induite.
La distinction essentielle est la spontanéité. La corrosion électrochimique se produit naturellement d'elle-même, comme une batterie qui se décharge. La corrosion électrolytique est imposée à un matériau par une source d'alimentation externe, comme un courant continu parasite provenant d'un système ferroviaire.

La cellule électrochimique : l'état naturel de la corrosion
Une cellule électrochimique, souvent appelée cellule galvanique, est le mécanisme derrière les formes les plus courantes de corrosion. C'est un processus autonome et naturel.
Une réaction chimique spontanée
Ce type de cellule se forme lorsque deux métaux différents sont en contact électrique en présence d'un électrolyte (comme l'eau salée). Un potentiel de tension naturel existe entre eux.
Le métal le plus chimiquement actif devient l'anode (électrode négative) et se corrode, libérant des électrons. Le métal le moins actif devient la cathode (électrode positive) et accepte ces électrons.
Conversion d'énergie : chimique en électrique
La force motrice est la libération de l'énergie chimique stockée dans le métal le plus actif. Cette énergie chimique est convertie directement en énergie électrique sous forme de flux d'électrons de l'anode vers la cathode. Ce processus ne nécessite aucune alimentation externe.
Un exemple classique est la corrosion galvanique, où une vis en acier (anode) rouille rapidement lorsqu'elle est connectée à un raccord en laiton (cathode) dans un environnement humide.
La cellule électrolytique : la corrosion par la force
Une cellule électrolytique provoque une réaction chimique qui ne se produirait pas normalement. Elle le fait en appliquant une source externe d'énergie électrique.
Une réaction chimique non spontanée
Ce processus surmonte les tendances naturelles des matériaux impliqués. La source d'alimentation externe force un métal à devenir une anode et à se corroder, même s'il serait stable autrement.
La corrosion se produit là où ce courant continu (CC) fourni de l'extérieur quitte la structure métallique pour pénétrer dans un électrolyte.
Conversion d'énergie : électrique en chimique
Ici, l'énergie électrique provenant d'une source extérieure est convertie en énergie chimique, qui se manifeste sous forme de réaction de corrosion. La cellule consomme de l'énergie pour fonctionner.
Un scénario courant dans le monde réel est la corrosion par courant vagabond. Un pipeline enterré passant près d'un chemin de fer alimenté en courant continu peut capter un courant de fuite, forçant la section du tuyau où le courant retourne au sol à se corroder à un rythme accéléré.
Comprendre les différences clés
Bien que les deux processus impliquent des anodes, des cathodes et un électrolyte, leurs caractéristiques fondamentales sont opposées. Reconnaître ces différences est essentiel pour un diagnostic et une atténuation appropriés.
Force motrice et source d'énergie
La distinction la plus importante est la force motrice. Une cellule électrochimique est auto-alimentée par la différence de potentiel chimique entre les matériaux. Une cellule électrolytique est alimentée de l'extérieur par une source de courant continu externe.
Polarité des électrodes
La polarité de l'anode et de la cathode est inversée entre les deux cellules, un point de confusion fréquent.
- Dans une cellule électrochimique (galvanique), l'anode (où la corrosion se produit) est négative, et la cathode est positive.
- Dans une cellule électrolytique, la source d'alimentation externe rend l'anode (où la corrosion se produit) positive, et la cathode est négative.
Implications pratiques
Une mauvaise identification du type de cellule de corrosion conduit à des solutions incorrectes. Par exemple, changer les paires de matériaux pourrait résoudre un problème de corrosion galvanique, mais ne ferait rien pour arrêter la corrosion par courant vagabond.
Poser le bon diagnostic
Comprendre le mécanisme sous-jacent est la première étape vers un contrôle efficace de la corrosion. Votre approche diagnostique doit être guidée par le type de cellule suspecté.
- Si votre objectif principal est de prévenir la corrosion naturelle : Vous avez probablement affaire à une cellule électrochimique (galvanique). Votre solution implique de sélectionner des matériaux compatibles, de les isoler électriquement ou d'appliquer une protection cathodique.
- Si vous enquêtez sur une corrosion rapide et localisée près d'équipements industriels ou de transports en courant continu : Vous avez presque certainement affaire à une cellule électrolytique. Votre priorité doit être de localiser et d'atténuer la source du courant vagabond externe.
En fin de compte, savoir si la corrosion se produit naturellement ou si elle est forcée par une influence externe dicte l'ensemble de votre stratégie de prévention et de contrôle.
Tableau récapitulatif :
| Caractéristique | Cellule électrochimique (galvanique) | Cellule électrolytique |
|---|---|---|
| Type de processus | Spontané | Non spontané, Forcé |
| Conversion d'énergie | Chimique → Électrique | Électrique → Chimique |
| Source d'alimentation | Interne (Potentiel chimique) | Source d'alimentation CC externe |
| Polarité de l'anode | Négative | Positive |
| Exemple courant | Corrosion galvanique (ex. acier/laiton) | Corrosion par courant vagabond (ex. des chemins de fer) |
Besoin de diagnostiquer et d'atténuer précisément la corrosion dans votre laboratoire ou processus industriel ?
Comprendre le type exact de cellule de corrosion est la première étape vers une solution efficace. Les experts de KINTEK sont spécialisés dans la fourniture d'équipements de laboratoire et de consommables précis nécessaires à l'analyse des matériaux et aux tests de corrosion. Que vous enquêtiez sur les réactions galvaniques ou les effets des courants vagabonds, nous avons les outils pour soutenir votre recherche et assurer l'intégrité des matériaux.
Contactez-nous dès aujourd'hui via notre formulaire de contact pour discuter de vos besoins spécifiques en laboratoire et découvrir comment les solutions de KINTEK peuvent améliorer vos stratégies de contrôle de la corrosion.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique de corrosion plane
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Le placage galvanique s'use-t-il ? Comprendre la durabilité et la durée de vie des finitions plaquées
- Quel est le mécanisme de la cellule électrolytique double de Devanathan-Stachurski ? Exploration des tests précis de perméation de l'hydrogène
- Comment un système d'électrolyseur est-il utilisé dans la recherche sur les cellules oxydes solides réversibles (RSOC) ? Drive Energy Innovation
- Quelle est la structure d'une cellule électrolytique à membrane échangeable de type H ? Un guide pour une séparation électrochimique précise
- Quels types d'électrodes sont utilisés dans une cellule électrolytique de type H ? Un guide du système essentiel à trois électrodes
- Quelle est la procédure de nettoyage de la cellule électrolytique après une expérience typique en solution aqueuse ? Un guide pour des résultats fiables
- Quelle est la fonction d'une cellule électrolytique en acier inoxydable dans les tests ESW ? Assurer une analyse précise des liquides ioniques
- Quels sont les avantages de l'utilisation d'un équipement de charge d'hydrogène électrolytique de laboratoire ? Vitesse et contrôle pour les études HIC



















