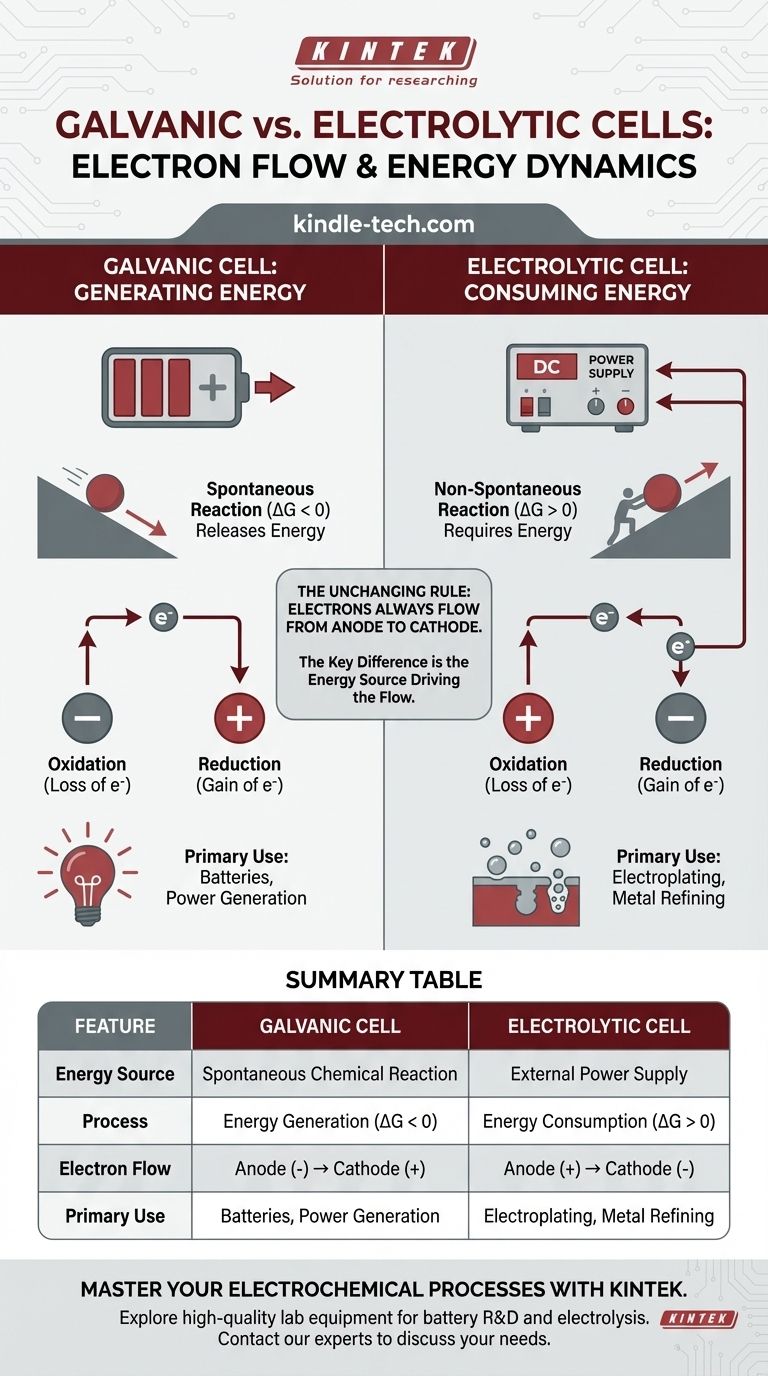
Dans toute cellule électrochimique, le flux d'électrons dans le circuit externe se fait toujours de l'anode vers la cathode. La distinction essentielle réside dans la raison pour laquelle ils circulent. Dans une cellule galvanique, une réaction chimique spontanée génère de l'énergie et pousse les électrons. Dans une cellule électrolytique, une source d'alimentation externe fournit l'énergie nécessaire pour forcer les électrons à circuler et entraîner une réaction non spontanée.
La différence fondamentale n'est pas la direction du flux d'électrons par rapport à l'oxydation et à la réduction, mais la source d'énergie qui entraîne le processus. Une cellule galvanique convertit l'énergie chimique stockée en énergie électrique, tandis qu'une cellule électrolytique utilise l'énergie électrique externe pour forcer un changement chimique.

Le principe fondamental : réactions spontanées contre non spontanées
Pour comprendre le flux d'électrons, vous devez d'abord comprendre la dynamique énergétique de la cellule. L'ensemble du système est régi par le fait que la réaction chimique se produit d'elle-même ou doit être forcée.
Cellules galvaniques : production d'énergie
Une cellule galvanique (également appelée pile voltaïque) exploite une réaction chimique spontanée. Considérez cela comme une balle roulant en descente : le processus libère naturellement de l'énergie.
Cette réaction spontanée a une énergie libre de Gibbs négative (ΔG < 0). Cette libération d'énergie chimique est directement convertie en énergie électrique, poussant les électrons de l'anode, à travers le circuit externe, vers la cathode.
Les cellules galvaniques sont à la base de toutes les batteries conventionnelles.
Cellules électrolytiques : consommation d'énergie
Une cellule électrolytique est utilisée pour entraîner une réaction chimique non spontanée. C'est comme pousser une balle en montée : cela nécessite un apport constant d'énergie externe pour se produire.
Cette réaction a une énergie libre de Gibbs positive (ΔG > 0). Une source d'alimentation externe, comme une batterie ou une alimentation, agit comme une « pompe à électrons ». Elle force les électrons sur la cathode et les retire de l'anode, entraînant une réaction qui ne se produirait pas d'elle-même.
Décortiquer le flux d'électrons et la polarité des électrodes
La confusion concernant le flux d'électrons provient souvent de la polarité changeante des électrodes. Bien que les rôles de l'anode et de la cathode soient fixes, leurs charges ne le sont pas.
La règle immuable : de l'anode à la cathode
Par définition, le site de l'oxydation (perte d'électrons) est toujours l'anode, et le site de la réduction (gain d'électrons) est toujours la cathode.
Puisque les électrons sont perdus à l'anode et gagnés à la cathode, les électrons dans le fil externe circulent toujours de l'anode vers la cathode. C'est une constante universelle pour les deux types de cellules.
La différence cruciale : la charge des électrodes
La polarité (la charge positive ou négative) des électrodes s'inverse entre les deux types de cellules, ce qui est la source de la plupart des confusions.
Dans une cellule galvanique, l'anode est le site de l'oxydation spontanée qui libère des électrons. Cette accumulation de charge négative fait de l'anode la borne négative (-). La cathode, qui consomme des électrons, devient la borne positive (+).
Dans une cellule électrolytique, la source d'alimentation externe dicte la polarité. Elle connecte sa borne négative à la cathode de la cellule pour forcer les électrons à s'y rendre et entraîner la réduction. Elle connecte sa borne positive à l'anode de la cellule pour retirer les électrons et entraîner l'oxydation.
- Cellule galvanique : Anode (-) vers Cathode (+)
- Cellule électrolytique : Anode (+) vers Cathode (-)
Comprendre les applications pratiques
La différence fondamentale de conversion de l'énergie détermine la façon dont ces cellules sont utilisées. L'une produit de l'énergie et l'autre la consomme pour produire des matériaux de valeur.
Cellules galvaniques : l'énergie sur demande
Le principal avantage d'une cellule galvanique est sa capacité à agir comme source d'énergie électrique portable.
Elles sont le fondement des batteries, des piles AA simples à la batterie de voiture. Leur principale limite est que les réactifs chimiques finissent par être consommés, ce qui entraîne une chute de la tension et l'épuisement de la batterie.
Cellules électrolytiques : forcer le changement chimique
Le but d'une cellule électrolytique est d'utiliser l'électricité pour créer un produit chimique.
Ce processus, connu sous le nom d'électrolyse, est essentiel pour les applications industrielles telles que le raffinage des métaux (par exemple, la production d'aluminium pur), le placage des surfaces avec une couche métallique protectrice et la décomposition de l'eau en hydrogène et en oxygène. Leur inconvénient est la nécessité d'un approvisionnement continu et souvent coûteux en énergie électrique.
Comment appliquer cela à votre objectif
Votre approche dépend entièrement de votre besoin de générer de l'électricité ou d'entraîner une réaction chimique.
- Si votre objectif principal est de générer de l'énergie ou de créer une batterie : Vous travaillez avec une cellule galvanique, où une réaction spontanée produit un courant électrique.
- Si votre objectif principal est de purifier un métal, de plaquer une surface ou de décomposer un composé : Vous avez besoin d'une cellule électrolytique, qui utilise une alimentation externe pour entraîner une réaction non spontanée.
- Si votre objectif principal est de comprendre le principe de base : Rappelez-vous que l'oxydation se produit toujours à l'anode et la réduction à la cathode ; la différence clé est de savoir si la réaction est spontanée (galvanique) ou forcée (électrolytique).
Comprendre cette distinction entre la libération spontanée d'énergie et l'apport forcé d'énergie est la clé pour maîtriser les cellules électrochimiques.
Tableau récapitulatif :
| Caractéristique | Cellule Galvanique | Cellule Électrolytique |
|---|---|---|
| Source d'énergie | Réaction chimique spontanée | Alimentation externe |
| Processus | Génération d'énergie (ΔG < 0) | Consommation d'énergie (ΔG > 0) |
| Flux d'électrons | Anode (-) → Cathode (+) | Anode (+) → Cathode (-) |
| Utilisation principale | Piles, production d'énergie | Galvanoplastie, raffinage des métaux |
Maîtrisez vos processus électrochimiques avec KINTEK
Que vous développiez de nouvelles technologies de batteries ou que vous raffiniez des matériaux par électrolyse, disposer de l'équipement de laboratoire approprié est crucial pour obtenir des résultats précis et fiables. KINTEK se spécialise dans les équipements et consommables de laboratoire de haute qualité, fournissant les outils précis dont vous avez besoin pour toute votre recherche et développement électrochimiques.
Laissez-nous vous aider à équiper votre laboratoire pour le succès. Contactez nos experts dès aujourd'hui pour discuter de vos besoins spécifiques et découvrir comment KINTEK peut soutenir votre travail révolutionnaire.
Guide Visuel
Produits associés
- Cellule électrolytique optique à double couche de type H avec bain-marie
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Cellule électrolytique de type H Triple Cellule électrochimique
- Cellule électrolytique en PTFE Cellule électrochimique scellée et non scellée résistante à la corrosion
Les gens demandent aussi
- Quels sont les volumes typiques et les configurations d'ouverture pour une cellule électrolytique à double couche à bain-marie ? Optimisez votre configuration électrochimique
- Quelle est la fonction principale des cellules électrolytiques dans la biolixiviation ? Récupérer des métaux de haute pureté avec un contrôle de précision
- Quelles sont les procédures de stockage appropriées pour la cellule électrolytique multifonctionnelle ? Protégez votre investissement et assurez la précision des données
- Quelle est la plage de température applicable pour la cellule électrolytique et comment la température est-elle contrôlée ? Obtenez des résultats électrochimiques précis
- Quelle est la fonction d'une cellule électrolytique à membrane échangeable de type H ? Maîtriser le contrôle précis des réactions
- Comment les produits et le liquide résiduel doivent-ils être manipulés après une expérience ? Assurer la sécurité et la conformité du laboratoire
- Quelles sont les exigences pour une cellule électrolytique avec une fenêtre en quartz ? Assurer des tests de performance PEC précis
- Comment nettoyer les fenêtres optiques en quartz de la cellule électrolytique ? Un guide pour maintenir la clarté optique



















