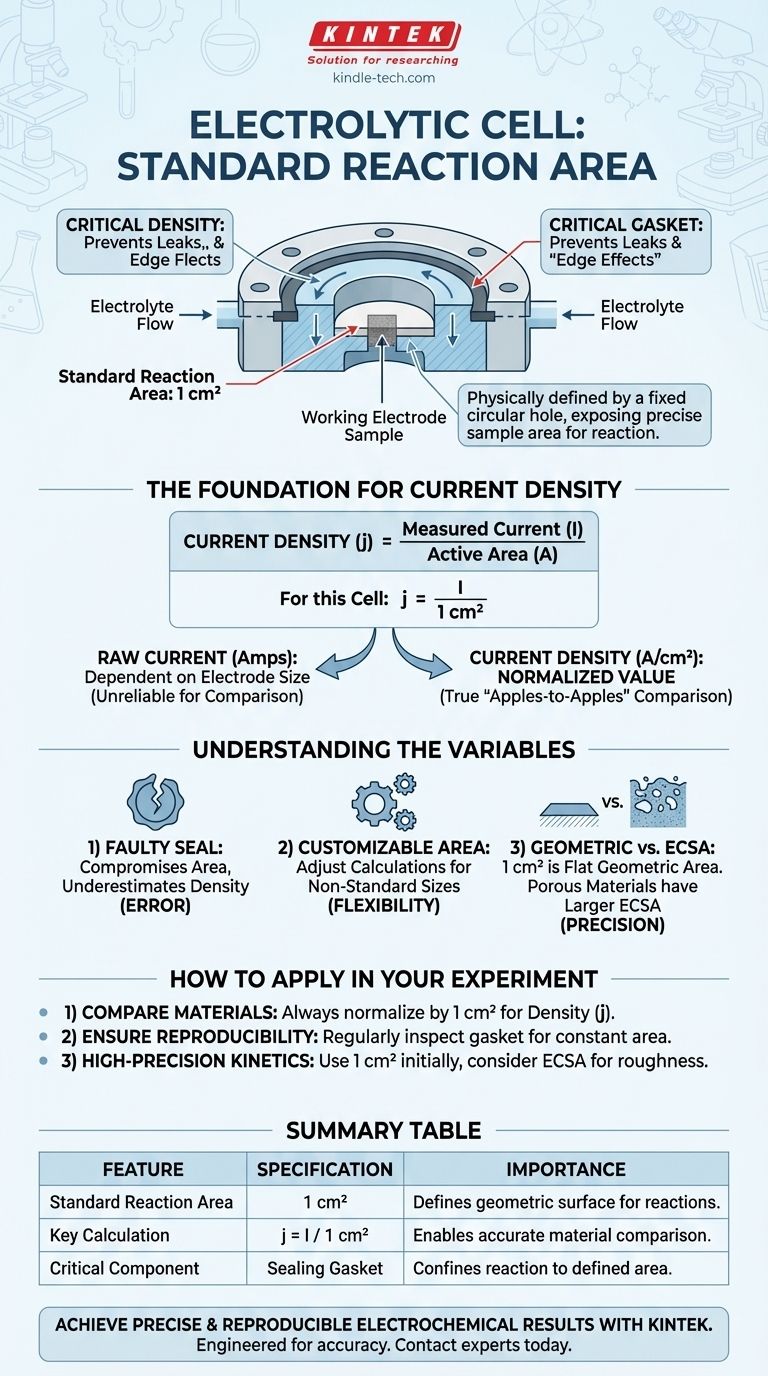
Sur la base des spécifications fournies, la surface de réaction standard de l'électrode de travail dans cette cellule électrolytique est de 1 centimètre carré (1 cm²). Cette surface est physiquement définie par un trou circulaire fixe au fond de la cellule, à travers lequel l'échantillon d'électrode de travail est exposé à l'électrolyte.
La question concernant la surface de l'électrode renvoie à un besoin plus fondamental : garantir que les résultats expérimentaux sont précis et comparables. La surface fixe de 1 cm² n'est pas seulement une dimension ; elle est le fondement du calcul de la densité de courant, la métrique universelle pour évaluer la performance électrochimique.

Le rôle de la surface de réaction fixe
La conception physique de la cellule est intentionnellement conçue pour contrôler les variables de votre expérience. L'ouverture définie pour l'électrode de travail est sans doute la caractéristique la plus critique.
Définir la surface active
Le trou de 1 cm² agit comme un masque, exposant uniquement une surface précise et connue de votre matériau échantillon (l'électrode de travail) à l'électrolyte. Toutes les réactions électrochimiques sont confinées à cette surface spécifique.
Cette conception garantit que la surface géométrique impliquée dans la réaction est constante d'une expérience à l'autre, ce qui est essentiel pour la reproductibilité.
La fonction critique du joint d'étanchéité
Un joint d'étanchéité est utilisé pour créer une étanchéité parfaite autour du périmètre de ce trou de 1 cm². Son objectif est double : empêcher l'électrolyte de fuir et empêcher la réaction de s'étendre au-delà de la zone définie.
Sans une étanchéité appropriée, une « corrosion par fissure » ou des « effets de bord » peuvent se produire, entraînant une surface de réaction mal définie et rendant vos mesures inexactes.
De la surface à la densité de courant : la véritable métrique
Connaître la surface de réaction est la première étape. L'objectif ultime est de l'utiliser pour calculer une valeur beaucoup plus révélatrice : la densité de courant.
Qu'est-ce que la densité de courant ?
La densité de courant est le courant électrique total mesuré dans une expérience divisé par la surface active de l'électrode. Elle est généralement exprimée en ampères par centimètre carré (A/cm²) ou en milliampères par centimètre carré (mA/cm²).
Pour cette cellule, le calcul est simple : Densité de courant (j) = Courant mesuré (I) / 1 cm².
Pourquoi c'est plus important que le courant brut
Le simple fait de mesurer le courant total (en Ampères) est insuffisant pour la comparaison, car cette valeur sera naturellement plus grande pour une électrode plus grande. Elle ne reflète pas l'efficacité intrinsèque ou l'activité du matériau d'électrode lui-même.
En normalisant le courant par la surface, vous créez une valeur — la densité de courant — qui permet une véritable comparaison directe entre différents matériaux, catalyseurs ou conditions expérimentales, quelles que soient les variations mineures de la taille de l'échantillon.
Comprendre les compromis et les considérations
Bien que la conception fournisse une norme, plusieurs facteurs doivent être gérés pour garantir l'intégrité de vos résultats.
L'impact d'un joint défectueux
Un joint usé, mal positionné ou chimiquement dégradé est une source principale d'erreur expérimentale. Si le joint est compromis, la surface de réaction réelle peut être plus grande que le 1 cm² supposé, vous amenant à sous-estimer la véritable densité de courant.
L'option de surface « personnalisable »
La note de référence indique que la taille du trou peut être personnalisée. Bien que 1 cm² soit une norme pratique, une surface différente peut être nécessaire pour certaines applications.
Par exemple, une surface plus petite peut être utilisée pour des matériaux très coûteux ou rares, tandis qu'une surface plus grande peut être nécessaire pour des matériaux ayant une conductivité très faible. Si vous utilisez une surface personnalisée, tous les calculs de densité de courant doivent être ajustés en conséquence.
Surface géométrique par rapport à la surface électrochimique (ECSA)
Il est essentiel de distinguer la surface géométrique (le cercle plat de 1 cm²) de la surface électrochimique (ECSA). Si votre matériau d'électrode est poreux, rugueux ou nanostructuré, sa véritable surface au niveau microscopique sera bien supérieure à 1 cm².
Pour la plupart des comparaisons de routine, la normalisation par la surface géométrique est suffisante. Cependant, pour les études cinétiques avancées, les chercheurs utilisent souvent des techniques telles que les mesures de capacité pour estimer l'ECSA afin d'obtenir une compréhension plus précise de l'activité catalytique.
Comment appliquer cela à votre expérience
Utilisez la surface standard comme référence pour générer des données fiables et significatives.
- Si votre objectif principal est de comparer différents matériaux : Normalisez toujours votre courant mesuré par la surface de 1 cm² pour calculer et rapporter la densité de courant (j).
- Si votre objectif principal est d'assurer la reproductibilité : Inspectez régulièrement le joint pour détecter l'usure et assurez-vous qu'il est correctement positionné avant chaque expérience afin de maintenir une surface de réaction constante de 1 cm².
- Si votre objectif principal est la cinétique de haute précision : Utilisez la surface géométrique de 1 cm² pour les calculs initiaux, mais envisagez de mesurer la véritable surface électrochimique (ECSA) si votre matériau présente un degré élevé de rugosité de surface.
En fin de compte, l'utilisation de la surface de réaction définie pour calculer la densité de courant est la clé pour produire des données électrochimiques reproductibles et comparables.
Tableau récapitulatif :
| Caractéristique | Spécification | Importance |
|---|---|---|
| Surface de réaction standard | 1 cm² | Définit la surface géométrique pour toutes les réactions. |
| Calcul clé | Densité de courant (j) = Courant mesuré (I) / 1 cm² | Permet une comparaison précise des différents matériaux. |
| Composant critique | Joint d'étanchéité | Prévient les fuites et garantit que la réaction est confinée à la surface de 1 cm². |
Obtenez des résultats électrochimiques précis et reproductibles avec KINTEK.
Nos cellules électrolytiques sont conçues avec une surface de réaction précisément définie de 1 cm² pour éliminer les variables et fournir la base de calculs précis de la densité de courant. Cela garantit que vos données sur la performance du catalyseur, l'efficacité des matériaux et la cinétique des réactions sont fiables et comparables.
KINTEK se spécialise dans les équipements de laboratoire et les consommables de haute qualité pour tous vos besoins en laboratoire. Laissez notre expertise soutenir votre recherche.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont nos équipements peuvent améliorer votre flux de travail électrochimique.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrolytique électrochimique à bain-marie double couche
- Cellule électrolytique de type H Triple Cellule électrochimique
Les gens demandent aussi
- Quelle précaution générale doit être prise lors de la manipulation de la cellule électrolytique ? Assurer des résultats de laboratoire sûrs et précis
- De quel matériau est fabriquée la cellule électrolytique à cinq ports à bain-marie ? Verre borosilicaté et PTFE expliqués
- Quelle est la bonne façon de manipuler une cellule électrolytique à bain-marie à cinq orifices ? Assurer des expériences électrochimiques précises et sûres
- Comment entretenir le corps d'une cellule électrolytique pour assurer sa longévité ? Prolongez la durée de vie de votre équipement
- Comment prévenir les fuites lors de l'utilisation d'une cellule électrolytique à cinq ports avec bain-marie ? Assurez une configuration électrochimique fiable et sûre



















