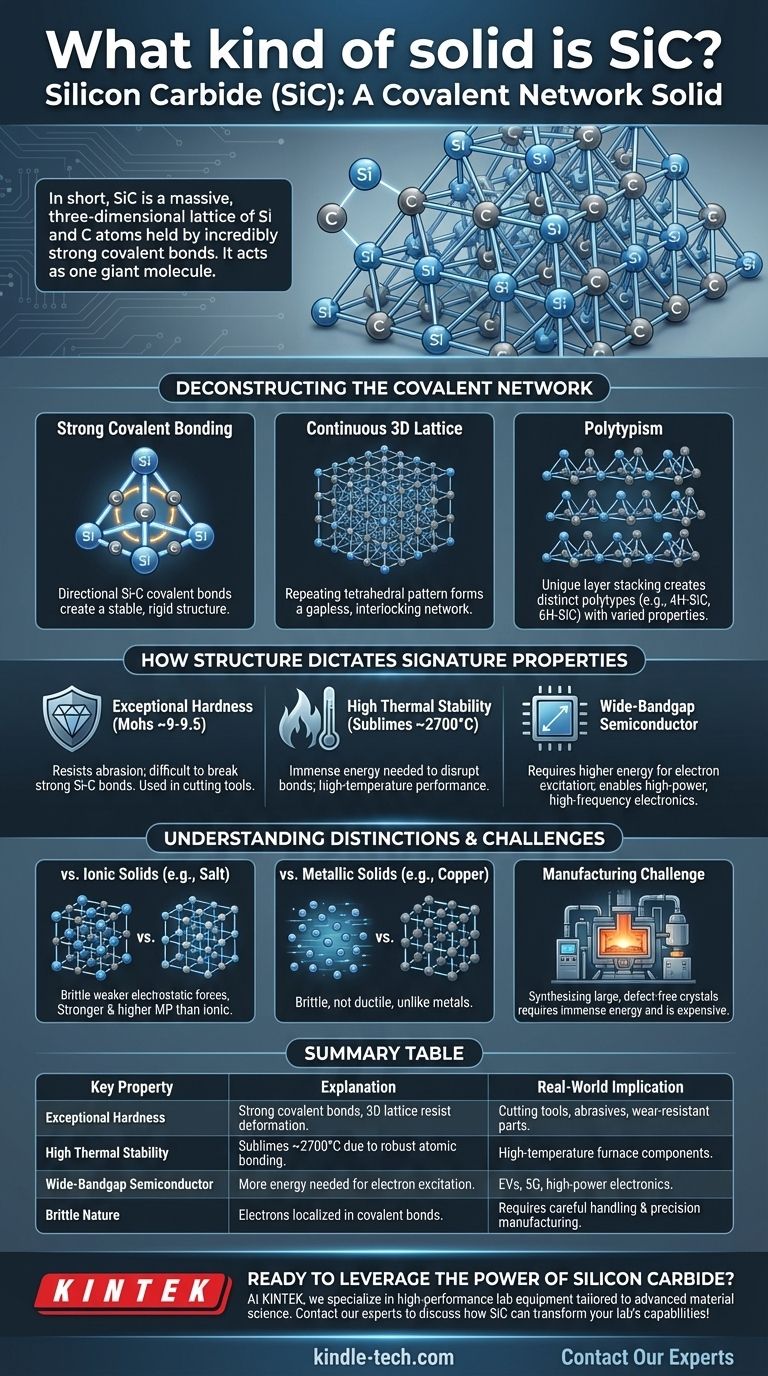
En bref, le carbure de silicium (SiC) est un solide à réseau covalent. Cette classification signifie que ses atomes de silicium et de carbone sont enfermés dans un réseau tridimensionnel massif, maintenu par des liaisons covalentes extrêmement fortes et directionnelles. Contrairement aux solides moléculaires avec des forces faibles entre les molécules, l'ensemble du cristal de SiC agit efficacement comme une seule et même molécule géante.
La classification du SiC comme solide à réseau covalent n'est pas seulement une étiquette ; c'est l'explication fondamentale de ses propriétés exceptionnelles. Comprendre son réseau atomique rigide est la clé pour saisir son extrême dureté, sa stabilité à haute température et son comportement électronique unique.

Déconstruire la structure du réseau covalent
Pour comprendre le SiC, vous devez d'abord visualiser son architecture atomique sous-jacente. C'est cette structure qui dicte presque toutes ses caractéristiques utiles.
La nature de la liaison covalente dans le SiC
Le carbure de silicium est formé d'atomes de silicium (Si) et de carbone (C). Ces deux éléments ont une différence d'électronégativité relativement faible, ce qui les amène à partager des électrons et à former des liaisons covalentes très fortes et stables.
Ces liaisons sont très directionnelles. Chaque atome de carbone est lié à quatre atomes de silicium, et chaque atome de silicium est lié à quatre atomes de carbone dans un arrangement tétraédrique rigide.
Un réseau 3D continu
Ce motif de liaison tétraédrique se répète à l'infini dans les trois dimensions. Cela crée un réseau continu et imbriqué sans points faibles ni molécules individuelles.
Considérez-le comme une structure similaire au diamant, mais avec des atomes de silicium et de carbone alternés au lieu de seulement du carbone. Cette structure rigide et sans lacunes est la source de l'immense résistance physique du SiC.
Le concept de polytypisme
Une caractéristique unique du SiC est le polytypisme. Bien que la liaison tétraédrique Si-C locale soit constante, les couches de ces tétraèdres peuvent être empilées selon différentes séquences.
Ces différents arrangements d'empilement créent des structures cristallines distinctes appelées polytypes, telles que le 4H-SiC et le 6H-SiC. Bien que tous soient du SiC, ces polytypes ont des propriétés électroniques légèrement différentes, ce qui les rend adaptés à différentes applications semi-conductrices.
Comment la structure dicte les propriétés caractéristiques du SiC
Le modèle de réseau covalent explique directement pourquoi le SiC se comporte comme il le fait. Les propriétés macroscopiques du matériau sont une conséquence directe de sa liaison et de sa structure microscopiques.
Dureté et résistance exceptionnelles
Pour rayer ou déformer le SiC, il faut briser physiquement les puissantes liaisons covalentes Si-C. Comme l'ensemble du cristal est un réseau unique de ces liaisons, il présente une incroyable résistance à l'abrasion et à la déformation.
Sur l'échelle de Mohs, le SiC (~9-9,5) est le deuxième après le diamant (10), ce qui en fait un matériau d'élite pour les outils de coupe, les abrasifs et les composants résistants à l'usure.
Haute stabilité thermique
La fusion ou la décomposition d'un solide nécessite de donner à ses atomes suffisamment d'énergie pour surmonter les forces qui les maintiennent ensemble. L'immense force des liaisons covalentes Si-C signifie qu'une énorme quantité d'énergie thermique est nécessaire pour perturber le réseau.
Par conséquent, le SiC ne fond pas à pression atmosphérique mais se sublime (se transforme directement en gaz) à des températures extrêmement élevées, environ 2700 °C (4900 °F).
Comportement semi-conducteur unique
Bien que les liaisons fortes soient caractéristiques d'un isolant électrique comme le diamant, l'énergie nécessaire pour exciter un électron dans un état conducteur (la bande interdite) dans le SiC est inférieure à celle du diamant.
Cela place le SiC dans une catégorie spéciale de semi-conducteurs à large bande interdite. Sa bande interdite est significativement plus large que celle du silicium pur, ce qui permet aux composants électroniques à base de SiC de fonctionner à des tensions, températures et fréquences beaucoup plus élevées.
Comprendre les compromis et les distinctions
Placer le SiC dans le contexte d'autres solides clarifie sa position unique. Ses propriétés sont un compromis défini par sa liaison.
SiC vs. Solides ioniques (ex : sel)
Les solides ioniques comme le chlorure de sodium (NaCl) sont maintenus ensemble par une attraction électrostatique non directionnelle entre les ions positifs et négatifs. Bien qu'ils forment des cristaux, ces liaisons sont généralement plus faibles que les liaisons covalentes du SiC, ce qui les rend plus tendres et leur confère des points de fusion beaucoup plus bas.
SiC vs. Solides métalliques (ex : cuivre)
Les métaux sont caractérisés par une "mer" d'électrons délocalisés entourant un réseau d'ions positifs. Cette mer d'électrons permet aux métaux d'être conducteurs et ductiles (malléables). En revanche, les électrons du SiC sont enfermés dans des liaisons covalentes localisées, ce qui en fait un semi-conducteur et le rend intrinsèquement fragile.
Le défi de la fabrication
La force même qui rend le SiC si désirable le rend également incroyablement difficile à produire. La synthèse de grands monocristaux de SiC sans défauts nécessite une énergie immense et des processus sophistiqués (comme la méthode de Lely), ce qui le rend significativement plus cher que le silicium.
Faire le bon choix pour votre application
Comprendre la classification du SiC comme solide à réseau covalent vous permet de prédire son comportement et ses meilleurs cas d'utilisation.
- Si votre objectif principal est la performance mécanique : Reconnaissez que son réseau covalent est la source directe de sa dureté et de sa résistance à l'usure de premier ordre, ce qui le rend idéal pour les abrasifs, le sablage et les joints mécaniques durables.
- Si votre objectif principal est l'électronique de puissance : Comprenez que son réseau covalent crée un semi-conducteur à large bande interdite, essentiel pour construire des onduleurs de puissance robustes, des chargeurs de VE et des modules de communication 5G qui surpassent le silicium.
- Si votre objectif principal est la science des matériaux : Classez le SiC comme un solide à réseau covalent prototypique, en l'utilisant comme référence pour la dureté et la stabilité thermique lors de la comparaison avec d'autres céramiques avancées comme le nitrure de bore ou le nitrure de silicium.
En fin de compte, savoir que le carbure de silicium est un solide à réseau covalent est le premier principe pour comprendre et appliquer ses capacités extraordinaires.
Tableau récapitulatif :
| Propriété clé | Explication | Implication dans le monde réel |
|---|---|---|
| Dureté exceptionnelle | Les liaisons covalentes fortes dans un réseau 3D résistent à la déformation. | Idéal pour les outils de coupe, les abrasifs et les pièces résistantes à l'usure. |
| Haute stabilité thermique | Se sublime à ~2700°C grâce à une liaison atomique robuste. | Convient aux applications à haute température comme les composants de four. |
| Semi-conducteur à large bande interdite | Les électrons nécessitent plus d'énergie pour être excités, permettant un fonctionnement à haute puissance. | Utilisé dans les VE, la technologie 5G et l'électronique de puissance pour des performances supérieures. |
| Nature fragile | Les électrons sont localisés dans les liaisons covalentes, limitant la ductilité. | Nécessite une manipulation soigneuse et des processus de fabrication de précision. |
Prêt à exploiter la puissance du carbure de silicium dans votre laboratoire ? Chez KINTEK, nous sommes spécialisés dans la fourniture d'équipements de laboratoire et de consommables haute performance adaptés aux besoins de la science des matériaux avancés. Que vous développiez des semi-conducteurs de nouvelle génération ou que vous ayez besoin de composants durables pour des processus à haute température, notre expertise vous assure d'obtenir les bonnes solutions pour des résultats supérieurs. Contactez nos experts dès aujourd'hui pour discuter de la façon dont le SiC peut transformer les capacités de votre laboratoire !
Guide Visuel
Produits associés
- Plaque céramique carbure de silicium (SiC) ingénierie résistante à l'usure céramiques fines avancées
- Éléments chauffants thermiques au carbure de silicium (SiC) pour four électrique
- Supports personnalisés en PTFE pour la laboratoire et le traitement des semi-conducteurs
- Lentille en silicium monocristallin à haute résistance infrarouge
- Pièces en céramique avancée en nitrure de bore (BN) pour l'ingénierie de précision
Les gens demandent aussi
- Lequel est le plus dur, le carbure de silicium ou le carbure de tungstène ? Découvrez la clé de la sélection des matériaux
- Quelle est la céramique la plus résistante ? Le carbure de silicium est en tête en termes de dureté et de résistance thermique
- Quelles sont les caractéristiques du SiC ? Débloquez les performances à haute température, dureté et inertie chimique
- Quelles sont les propriétés et les applications des céramiques de carbure de silicium ? Relever les défis d'ingénierie extrêmes
- Le carbure de silicium est-il meilleur que la céramique ? Découvrez la céramique technique supérieure pour votre application



















