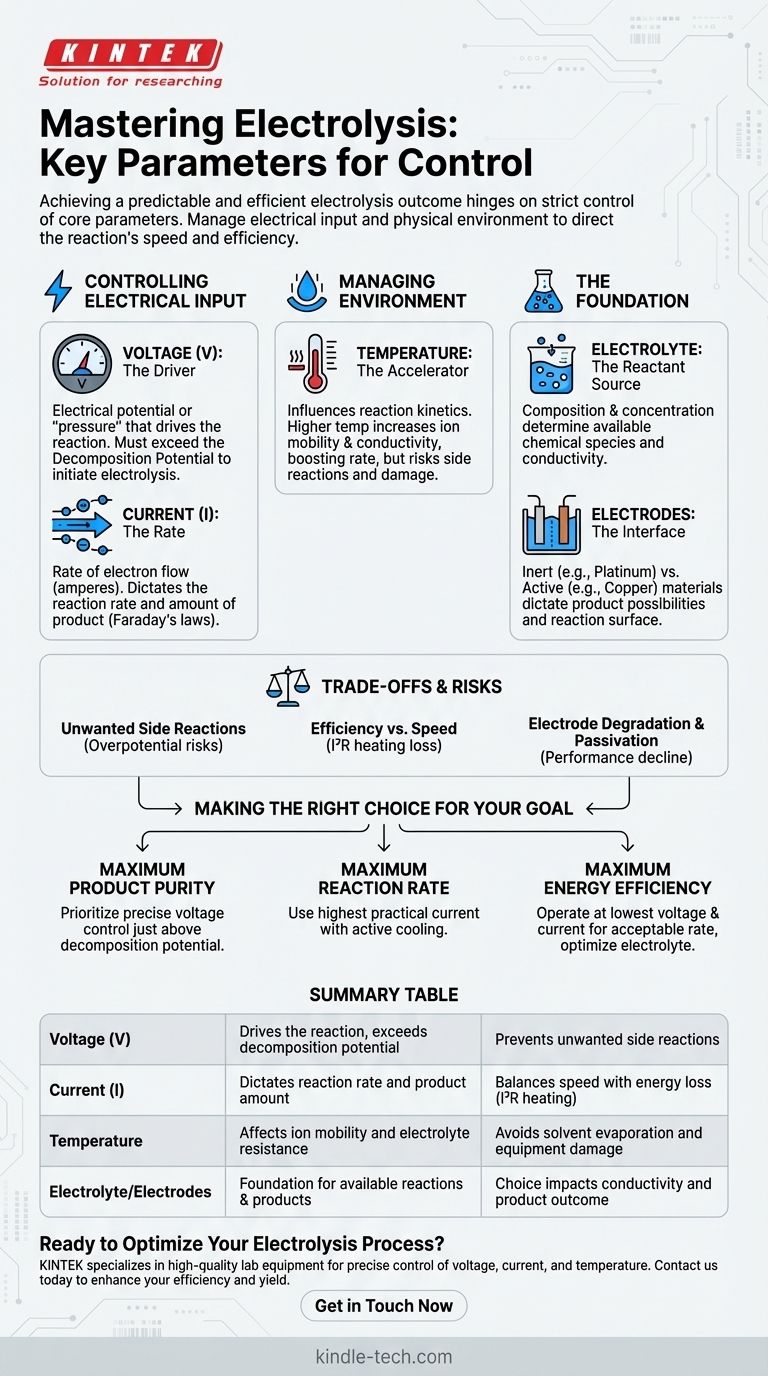
Dans toute installation d'électrolyse, l'obtention d'un résultat prévisible et efficace repose sur le contrôle strict de plusieurs paramètres fondamentaux. Pour garantir que la réaction se déroule comme prévu, vous devez gérer précisément l'apport électrique — spécifiquement la tension et le courant — ainsi que l'environnement physique, principalement la température de l'électrolyte. Ces trois variables sont les leviers principaux pour contrôler la vitesse et l'efficacité de la réaction.
Le défi fondamental de l'électrolyse n'est pas seulement d'initier une réaction, mais de la diriger. Bien que le contrôle de la tension, du courant et de la température soit la tâche immédiate, la véritable maîtrise vient de la compréhension de la manière dont ces paramètres, ainsi que votre choix d'électrolyte et d'électrodes, dictent les produits finaux et l'efficacité globale.

Les piliers du contrôle électrolytique
Une électrolyse réussie est un exercice d'équilibre. Chaque paramètre influence les autres et a un impact direct sur le résultat final. Comprendre leurs rôles individuels est la première étape vers la maîtrise du processus.
Contrôler l'apport électrique : Tension et Courant
L'alimentation électrique est le moteur de votre réaction. La tension (V) est le potentiel électrique ou la « pression » qui entraîne la réaction. Elle doit être suffisante pour dépasser le potentiel de décomposition de l'électrolyte, qui est la tension minimale requise pour que l'électrolyse commence.
Le courant (I), mesuré en ampères, est le débit du flux d'électrons. Selon les lois de Faraday sur l'électrolyse, la quantité de substance chimique produite est directement proportionnelle à la quantité de courant traversant le système au fil du temps. En bref, le courant dicte la vitesse de la réaction.
Gérer l'environnement de réaction : La température
La température influence la cinétique de la réaction. L'augmentation de la température diminue généralement la viscosité de la solution et augmente la mobilité des ions, ce qui diminue à son tour la résistance électrique de l'électrolyte.
Cela permet une vitesse de réaction plus élevée à une tension donnée. Cependant, une chaleur excessive peut provoquer des réactions secondaires indésirables, entraîner l'évaporation du solvant ou même endommager l'équipement.
La fondation : Électrolyte et Électrodes
Bien qu'ils ne soient pas des variables de processus dynamiques de la même manière que la température ou le courant, le choix initial de l'électrolyte et des électrodes est l'acte de contrôle le plus fondamental dont vous disposez.
La composition et la concentration de l'électrolyte déterminent quelles espèces chimiques sont disponibles pour réagir. Des concentrations plus élevées augmentent généralement la conductivité mais peuvent également modifier les réactions favorisées aux électrodes.
Le matériau de l'électrode détermine si l'électrode fournit simplement une surface pour la réaction (électrodes inertes comme le platine ou le graphite) ou y participe directement (électrodes actives comme le cuivre ou le zinc), modifiant fondamentalement les produits possibles.
Comprendre les compromis et les risques
Contrôler l'électrolyse ne consiste pas seulement à régler des cadrans ; il s'agit de naviguer entre des compromis et d'éviter les pièges courants qui peuvent ruiner vos résultats.
Le risque de réactions secondaires indésirables
Appliquer une tension significativement supérieure au potentiel de décomposition est une erreur courante. Cette « surtension » peut fournir suffisamment d'énergie pour déclencher des réactions involontaires, telles que l'électrolyse de l'eau elle-même, ce qui réduit l'efficacité du courant pour votre produit cible.
Efficacité contre Vitesse
Il existe un compromis constant entre la vitesse et l'efficacité énergétique. Pousser pour une vitesse de réaction élevée en augmentant le courant augmente également les pertes de chaleur résistives (échauffement I²R). Cela gaspille de l'énergie et nécessite un contrôle de la température plus robuste, ajoutant de la complexité et des coûts.
Dégradation et Passivation des Électrodes
Même les électrodes considérées comme « inertes » peuvent se dégrader dans des conditions extrêmes de tension ou de densité de courant. Plus critique encore, la surface d'une électrode peut se recouvrir d'une couche isolante de produit — un phénomène appelé passivation — qui peut ralentir ou arrêter complètement le processus d'électrolyse.
Faire le bon choix pour votre objectif
La stratégie de contrôle optimale dépend entièrement de ce que vous souhaitez accomplir. Utilisez votre objectif principal pour guider la manière dont vous gérez les paramètres clés.
- Si votre objectif principal est une pureté maximale du produit : Privilégiez un contrôle précis de la tension pour rester juste au-dessus du potentiel de décomposition de votre réaction cible, évitant ainsi les réactions secondaires.
- Si votre objectif principal est une vitesse de réaction maximale : Utilisez le courant pratique le plus élevé que votre système peut supporter tout en mettant en œuvre un système de refroidissement actif pour gérer l'augmentation de température qui en résulte.
- Si votre objectif principal est une efficacité énergétique maximale : Fonctionnez à la tension et au courant les plus bas possibles qui produisent encore un taux acceptable, et optimisez la concentration de l'électrolyte pour minimiser la résistance.
La maîtrise de ces paramètres transforme l'électrolyse d'une simple démonstration en un outil de fabrication chimique précis et prévisible.
Tableau récapitulatif :
| Paramètre | Rôle principal | Considération clé |
|---|---|---|
| Tension (V) | Entraîne la réaction, doit dépasser le potentiel de décomposition | Prévient les réactions secondaires indésirables |
| Courant (I) | Dicte la vitesse de réaction et la quantité de produit | Équilibre la vitesse avec la perte d'énergie (échauffement I²R) |
| Température | Affecte la mobilité des ions et la résistance de l'électrolyte | Évite l'évaporation du solvant et les dommages à l'équipement |
| Électrolyte/Électrodes | Base pour les réactions et les produits disponibles | Le choix a un impact sur la conductivité et le résultat du produit |
Prêt à optimiser votre processus d'électrolyse ?
Atteindre un contrôle précis de la tension, du courant et de la température est essentiel pour des résultats efficaces et prévisibles. Que votre objectif soit une pureté maximale du produit, une vitesse de réaction élevée ou une efficacité énergétique optimale, le bon équipement de laboratoire est indispensable.
KINTEK est spécialisé dans les équipements et consommables de laboratoire de haute qualité, répondant à tous vos besoins de laboratoire. Des alimentations précises aux systèmes de contrôle de la température, nous fournissons les outils fiables dont vous avez besoin pour maîtriser vos paramètres d'électrolyse.
Contactez-nous dès aujourd'hui pour discuter de la manière dont nos solutions peuvent améliorer l'efficacité et le rendement de votre processus. Construisons ensemble un laboratoire plus contrôlé et plus productif.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique en quartz pour expériences électrochimiques
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrolytique électrochimique à bain-marie double couche
- Cellule de diffusion de gaz électrolytique électrochimique à flux liquide
- Cellule électrolytique optique à double couche de type H avec bain-marie
Les gens demandent aussi
- Quelles sont les étapes nécessaires pour préparer une cellule électrolytique tout-quartz avant une expérience ? Assurer la précision et la sécurité
- Pourquoi utilise-t-on une cellule électrolytique en quartz pour les eaux usées d'acide acrylique ? Assurer la stabilité chimique et l'intégrité des données
- Quelles sont les procédures opérationnelles et les précautions de sécurité lors d'une expérience utilisant une cellule électrolytique tout-quartz ? Assurez la sécurité et la précision dans votre laboratoire
- Quelles sont les principales applications de la cellule électrolytique entièrement en quartz ? Essentielle pour l'analyse de haute pureté et l'analyse optique
- Quelles sont les spécifications d'ouverture standard pour les cellules électrolytiques tout quartz scellées et non scellées ? Optimisez votre configuration électrochimique



















