Définition et fonction d'une électrode
Table des matières
Description d'une électrode
Une électrode est un point où le courant entre et sort de l’électrolyte. C'est un conducteur utilisé pour réaliser une jonction avec une partie non métallique d'un circuit. Les électrodes peuvent être constituées de matériaux tels que l'or, le platine, le carbone, le graphite ou le métal. Ils servent de surface aux réactions d’oxydo-réduction dans les cellules électrochimiques. Il existe différents types d’électrodes, dont l’anode et la cathode.
Rôle d'une électrode dans une cellule électrochimique
Les électrodes sont des composants essentiels des cellules électrochimiques. Ils transportent les électrons produits dans la cellule d’une demi-cellule à l’autre, créant ainsi une charge électrique. La cathode est l'électrode par laquelle le courant quitte la cellule, tandis que l'anode est l'électrode par laquelle le courant entre. L'électrolyte de la cellule agit comme un conduit pour le flux d'électrons entre la cathode et l'anode. Le potentiel de la cellule est calculé sur la base d'un système d'électrodes standard avec un potentiel de référence de 0 volt.

Différence entre une anode et une cathode
L'anode et la cathode jouent des rôles différents dans une cellule électrochimique. La cathode est chargée négativement dans les cellules électrolytiques et une réaction de réduction se produit au niveau de cette électrode. Les électrons pénètrent dans la cathode pendant le fonctionnement de la cellule. D'autre part, l'anode est chargée positivement dans les cellules électrolytiques et une réaction d'oxydation se produit au niveau de cette électrode. Les électrons sortent de l'anode pendant le fonctionnement de la cellule. Il est important de noter que les rôles de l’anode et de la cathode peuvent changer en fonction de la direction du flux électronique.
En résumé, les électrodes sont des conducteurs utilisés dans les cellules électrochimiques pour faciliter le transfert d'électrons. Ils jouent un rôle crucial dans le fonctionnement de ces cellules et sont classés en anodes ou cathodes en fonction du type de réaction chimique qui se produit. Comprendre les rôles et les fonctions des électrodes est essentiel dans l’étude de l’électrochimie.
Mécanique d'une électrode
Processus d'oxydation et de réduction à la surface de l'électrode
Une électrode est une surface métallique où un équilibre d'oxydo-réduction s'établit entre le métal et la solution dans laquelle il est placé. L'électrode peut être soit une anode, soit une cathode.
Anode : l'anode reçoit du courant ou des électrons du mélange électrolytique, ce qui provoque son oxydation. Lorsque des atomes ou des molécules s'approchent de la surface de l'anode, la solution cède des électrons, entraînant la formation d'ions positifs.
Cathode : La cathode, quant à elle, libère des électrons dans la solution, entraînant une réduction.
Une électrode doit être stable et résister à la corrosion, sauf dans les cas où l'électrode est sacrificielle ou utilisée pour des processus spécifiques. L'action mécanique peut provoquer une dégradation des électrodes, telle que la libération de particules de graphite, qui peuvent nécessiter une filtration. Le gonflement de l’électrode peut également poser problème avec certains matériaux.
Rôle de l'anode et de la cathode dans ces processus
Les anodes et cathodes jouent un rôle crucial dans les systèmes électrochimiques, tels que les batteries, les piles à combustible, les cellules photovoltaïques, les cellules électrolytiques et les diodes.

Anode : L'anode fait référence à l'électrode où se produit l'oxydation ou où les électrons s'écoulent. C'est la borne ou le conducteur par lequel les électrons quittent la cellule électrochimique, provoquant l'oxydation. Dans les cellules primaires, l'anode est fixe et ne peut pas être rechargée, tandis que dans les cellules secondaires, l'anode peut changer de polarité en fonction du sens du courant.
Cathode : La cathode fait référence à l'électrode où la réduction a lieu ou où les électrons entrent. Les électrons pénètrent dans la cellule par la cathode et sont impliqués dans les réactions de réduction. Semblable à l’anode, la cathode peut également changer de polarité dans les cellules secondaires.
La corrosion des électrodes peut être grave, en particulier lorsqu'il existe des potentiels fluctuants dans l'électrolyte ou lorsque différents métaux sont utilisés comme anode et cathode. Cependant, les inhibiteurs et d’autres méthodes préventives peuvent contribuer à réduire les attaques des électrodes.
L'électrolyse est un processus qui se produit dans les cellules électrolytiques, où l'énergie électrique est utilisée pour effectuer des réactions chimiques non spontanées. L'oxydation se produit à l'anode (plaque positive), tandis que la réduction se produit à la cathode (plaque négative).
Comprendre la mécanique d'une électrode, y compris les processus d'oxydation et de réduction, ainsi que les rôles de l'anode et de la cathode, est crucial dans diverses applications électrochimiques.
Composition matérielle d'une électrode
Exigences pour un matériau d'électrode
L'efficacité des cellules électrochimiques est déterminée par les propriétés physiques des électrodes. La composition matérielle d’une électrode joue un rôle crucial dans ses performances. La principale exigence d’un matériau d’électrode est la conductivité. Tout matériau conducteur tel que des métaux, des semi-conducteurs, du graphite ou des polymères conducteurs peut être utilisé comme électrode. Dans de nombreux cas, les électrodes sont constituées d’une combinaison de matériaux, chacun ayant une tâche spécifique. Ces matériaux comprennent :
- Matériaux actifs : Ce sont les particules qui subissent une oxydation ou une réduction dans l'électrode.
- Agents conducteurs : Ils améliorent la conductivité de l'électrode.
- Liants : Ils sont utilisés pour contenir les particules actives au sein de l’électrode.
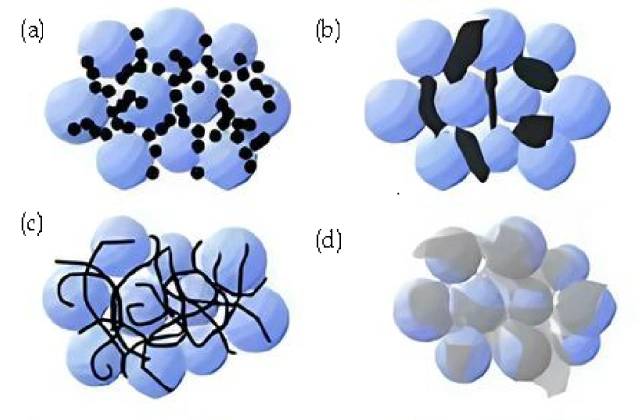
![Résumé des agents conducteurs (a. Noir de carbone, nanoparticules rigides ; contact point à point. b. Graphite conducteur, particules microniques rigides ; contact point à point. c. Nanotubes de carbone, flexibles ; contact linéaire et ponctuel d. Graphite , feuille flexible ; surface et contact ponctuel. )]()
Résumé des agents conducteurs (a. Noir de carbone, nanoparticules rigides ; contact point à point. b. Graphite conducteur, particules microniques rigides ; contact point à point. c. Nanotubes de carbone, flexibles ; contact linéaire et ponctuel d. Graphite , feuille flexible ; surface et contact ponctuel. )
En plus de la conductivité, d'autres propriétés importantes des électrodes comprennent la résistivité électrique, la capacité thermique spécifique, le potentiel de l'électrode et la dureté. Le coût du matériau est également un facteur important à considérer pour les applications technologiques.
Exemples d'électrodes inertes et réactives
Une électrode peut être inerte ou réactive, selon son implication dans la réaction d'oxydo-réduction (redox). Les électrodes inertes ne participent pas à la réaction et ne réagissent pas chimiquement. Des exemples d'électrodes inertes comprennent le graphite (carbone), le platine, l'or et le rhodium. Ces matériaux sont utilisés lorsque le seul objectif de l'électrode est de faciliter la circulation du courant dans la cellule électrochimique.
En revanche, les électrodes réactives participent activement à la réaction redox. Ils subissent une oxydation ou une réduction avec les réactifs. Par exemple, une électrode en magnésium est une électrode active car elle participe à la réaction. Le choix entre des électrodes inertes et réactives dépend des exigences spécifiques du processus électrochimique.
Rôle de l'électrode dans la réaction
L'électrode sert de plate-forme pour que la réaction redox se produise. Dans certains cas, des formes solides des réactifs sont utilisées comme électrodes. Par exemple, dans une cellule électrochimique cuivre-argent, le cuivre et l’argent sont à la fois les réactifs et les électrodes. Les électrodes réactives facilitent le transfert d’électrons et d’ions lors de la réaction redox.
Alternativement, dans les réactions nécessitant une électrode inerte, un métal qui ne participe pas à la réaction est utilisé. Un exemple de ceci est le platine dans la réaction de l’électrode standard à hydrogène (SHE). L'électrode inerte permet la circulation du courant sans interférer avec la réaction chimique.
Le choix du matériau de l’électrode est crucial pour obtenir des rendements et une sélectivité optimaux dans les processus électrochimiques. Les propriétés du matériau influencent la cinétique et la thermodynamique du transfert d'électrons et peuvent déterminer le succès ou l'échec d'une transformation. Des considérations telles que le coût, la stabilité et la manipulabilité sous diverses formes jouent également un rôle dans la sélection du matériau d'électrode approprié.
La composition du matériau et la structure interne d’une électrode sont des facteurs essentiels qui déterminent ses performances. La combinaison de matériaux actifs, d'agents conducteurs et de liants dans une suspension d'électrode améliore sa conductivité et sa fonctionnalité. Le mélange est ensuite déposé sur un conducteur qui joue le rôle de collecteur de courant dans la cellule électrochimique.
En résumé, la composition matérielle d’une électrode, qu’elle soit inerte ou réactive, a un impact significatif sur son efficacité et sa fonctionnalité dans les processus électrochimiques. Le choix du matériau de l'électrode doit être basé sur les exigences spécifiques de l'application, en tenant compte de facteurs tels que la conductivité, la stabilité et le coût.
Exemples d'électrodes
Exemples d'électrodes inertes et réactives couramment utilisées
La distinction peut être faite entre les électrodes actives et les électrodes inertes. Par exemple, une électrode de magnésium est généralement une électrode active car elle participe à la réaction d’oxydo-réduction (redox). Une électrode de platine est généralement une électrode inerte car elle ne participe pas à la réaction d'oxydo-réduction. Une électrode inerte est chimiquement non réactive et n'est présente que pour que le courant puisse circuler à travers la cellule électrochimique.
Exemples d'électrodes en chimie analytique
Des exemples de matériaux typiques utilisés pour les électrodes en chimie analytique sont le carbone amorphe, l'or et le platine. Les électrodes en verre sont souvent utilisées dans les mesures de pH ; dans cette application, le verre est dopé chimiquement pour être sélectif aux ions hydrogène.
Exemples d'électrodes dans les batteries
Les batteries contiennent diverses électrodes, selon le type de batterie.
- Les batteries au plomb sont basées sur des électrodes au plomb.
- Les batteries zinc-carbone sont fabriquées avec des électrodes de zinc et de carbone amorphe.
- Les batteries au lithium polymère comportent des électrodes constituées d'une matrice polymère solide à l'intérieur de laquelle les ions lithium peuvent se déplacer et agir comme porteurs de charge.
![Batteries au plomb, batteries au zinc-carbone et batteries au lithium-polymère]()
Batteries au plomb, batteries au zinc-carbone et batteries au lithium-polymère
Exemples d'électrodes en électrolyse
L'énergie électrique peut être utilisée pour convertir les sels et les minerais en métaux.
- Dans le procédé Hall-Héroult permettant d'extraire l'aluminium métallique de l'oxyde d'aluminium, l'anode et la cathode sont toutes deux en graphite.
- Le sodium métallique est produit par électrolyse à l’aide d’une anode de carbone et d’une cathode de fer.
Électrodes inertes
Un métal qui n’interfère ni ne participe à aucune réaction chimique est appelé électrode inerte. Cependant, il est toujours utilisé pour transférer de l’électricité en faisant passer des électrons à travers la solution au lieu d’échanger des ions.
Des exemples d'électrodes inertes comprennent le graphite, le platine, l'or et le rhodium.
Électrodes en analyse quantitative
Dans l'analyse potentiométrique, une électrode indicatrice réagit aux différences d'activité de l'analyte ou de « concentration efficace ». Cette simplicité fait de la potentiométrie une technique économique par rapport à la spectroscopie atomique ou à la chromatographie ionique. Ces procédures peuvent être classées en fonction des aspects de la cellule qui sont contrôlés.
Utilisations des électrodes
Les électrodes sont utilisées pour fournir du courant à travers des objets non métalliques afin de les modifier de nombreuses manières et de mesurer la conductivité à diverses fins. Voici quelques exemples :

- Électrodes pour piles à combustible
- Électrodes à usage médical, telles que EEG (pour enregistrer l'activité cérébrale), ECG (pour enregistrer les battements cardiaques), ECT (stimulation électrique du cerveau), défibrillateur (pour enregistrer et délivrer une stimulation cardiaque)
- Électrodes pour les techniques d'électrophysiologie dans la recherche biomédicale
- Électrodes pour exécution par la chaise électrique
- Électrodes pour galvanoplastie
- Électrodes pour le soudage à l'arc
- Électrodes pour protection cathodique
- Électrodes pour la mise à la terre
- Électrodes pour analyses chimiques par méthodes électrochimiques
- Nanoélectrodes pour des mesures de haute précision en nanoélectrochimie
- Électrodes inertes pour électrolyse (en platine)
- Ensemble d'électrodes à membrane
- Électrodes pour arme à électrochocs Taser
Électrode à hydrogène standard (SHE)
Définition et importance de ELLE
Une électrode à hydrogène standard (SHE) est une électrode que les scientifiques utilisent comme référence pour toutes les réactions potentielles des demi-cellules. La valeur du potentiel d’électrode standard est nulle, ce qui en fait la base du calcul des potentiels de cellules utilisant différentes électrodes ou concentrations. Avoir une électrode de référence commune comme le SHE est crucial pour des mesures et des comparaisons précises dans les expériences électrochimiques.
Composition du matériau et processus de réaction de SHE
Le SHE est composé d'une solution 1,0 M H+(aq) contenant un morceau carré de platine platiné. Le platine est connecté à un fil de platine, permettant l'échange électronique. À l’intérieur d’un tube de verre, de l’hydrogène gazeux passe à travers et dans la solution, entraînant la réaction suivante :
2H+(aq) + 2e- ⇌ H2(g)
Cet équilibre entre les ions hydrogène et l’hydrogène gazeux établit le potentiel de référence du SHE.

Défis liés à la mise en place et à l’utilisation de SHE
La mise en place et l’utilisation du SHE peuvent présenter certains défis. L’un des défis consiste à assurer la stabilité de l’électrode de référence dans le temps et avec les changements de température. Les composants du SHE doivent être stables et fournir des potentiels d’électrode fixes et reproductibles.
Un autre défi réside dans la construction de l’électrode de référence. Le SHE se compose d'une enveloppe en verre avec une petite entrée en haut et plusieurs sorties en bas. À l’intérieur de la gaine de verre se trouve un tube de verre scellé aux deux extrémités, contenant le fil de platine platiné et une plaque de platine platiné à l’extrémité inférieure. La veste en verre et le tube sont immergés dans un récipient contenant une solution de HCl 1 M. La bonne construction de ces composants est essentielle au bon fonctionnement du SHE.
En résumé, l’électrode standard à hydrogène est un outil essentiel en électrochimie, servant de référence pour mesurer et comparer les potentiels des électrodes. Sa construction et son utilisation nécessitent une attention particulière pour garantir la stabilité et la précision des mesures expérimentales.
Système à trois électrodes
Le système à trois électrodes est un composant essentiel de la voltammétrie. Il se compose de trois électrodes : l’électrode de travail, l’électrode de référence et l’électrode auxiliaire. Chaque électrode joue un rôle spécifique dans le système.
Description du système à trois électrodes
Le système à trois électrodes est utilisé en chimie électroanalytique pour effectuer une analyse voltamétrique. Il permet de mesurer et de contrôler le flux de courant dans une cellule électrochimique. Le système se compose des électrodes suivantes :
Électrode de travail : L'électrode de travail est responsable du transport des électrons vers et depuis les substances présentes dans la cellule. Il facilite les réactions électrochimiques qui se produisent lors de la voltamétrie.
Électrode de référence : Une électrode de référence a un potentiel d'électrode établi. Il peut être utilisé comme demi-cellule dans une cellule électrochimique. En comparant le potentiel de l'électrode de travail avec l'électrode de référence, le potentiel de l'électrode de travail peut être déterminé.
Électrode auxiliaire : L'électrode auxiliaire garantit que le courant ne traverse pas la cellule de référence. Il équilibre le courant avec celui de l'électrode de travail. L’électrode auxiliaire est également appelée contre-électrode.
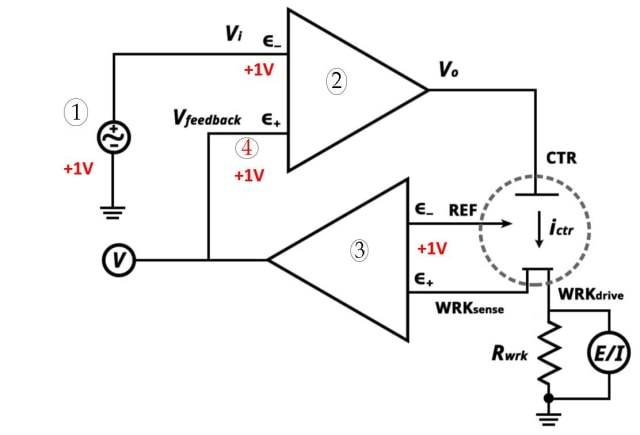
![Système à trois électrodes (1. Point de consigne potentiostatique 2. Amplificateur opérationnel à gain élevé 3. Électromètre 4. Très proche)]()
Système à trois électrodes (1. Point de consigne potentiostatique 2. Amplificateur opérationnel à gain élevé 3. Électromètre 4. Très proche)
Rôles des électrodes de travail, de référence et auxiliaires
Dans le système à trois électrodes, chaque électrode a un rôle spécifique à jouer :
L'électrode de travail facilite les réactions électrochimiques en transportant les électrons vers et depuis les substances présentes dans la cellule.
L'électrode de référence fournit un potentiel d'électrode connu par rapport auquel le potentiel de l'électrode de travail peut être mesuré. Il sert de point de référence pour déterminer le potentiel d’électrode de l’électrode de travail.
L'électrode auxiliaire, également appelée contre-électrode, garantit que le courant traverse la cellule électrochimique sans passer par l'électrode de référence. Il équilibre le courant avec celui de l'électrode de travail.
Le système à trois électrodes offre des avantages distincts par rapport aux configurations à deux électrodes. Il permet d'isoler l'électrode de travail, permettant ainsi l'étude de réactions spécifiques avec précision et confiance. Cette configuration est couramment utilisée dans l’expérimentation électrochimique.
Les configurations à deux électrodes, en revanche, sont utilisées dans les cas où la mesure de la tension de la cellule entière est importante, comme dans les dispositifs à énergie électrochimique comme les batteries, les piles à combustible et les supercondensateurs. Il peut également être utilisé lorsque l’on s’attend à ce que le potentiel de la contre-électrode reste stable tout au long de l’expérience.
Dans l’ensemble, le système à trois électrodes est un outil crucial en voltamétrie, permettant une mesure et un contrôle précis des réactions électrochimiques.
Exemples d'électrodes de référence
Description et procédé de l'électrode Calomel
L'électrode au calomel est constituée d'un tube de verre avec une arme de poing. Au fond du tube se trouve du mercure pur dans lequel est scellé un fil de platine pour les connexions électriques. Au dessus du mercure, il y a une pâte de chlorure mercureux (calomel) dans le mercure. Le reste du tube est rempli d'une solution saturée de KCl. Le pistolet est utilisé pour le plonger dans n'importe quelle solution utilisée pour coupler l'électrode au calomel.

Fonctionnement : L'électrode au calomel peut agir comme une électrode négative, et deux réactions sont possibles selon la nature de l'autre électrode à laquelle elle est couplée. Lorsqu'elle agit comme une électrode négative, les réactions suivantes se produisent :
- 2 Hg(l) → 2 Hg+ + 2 e–
- 2 Hg+ + 2 Cl– → Hg2Cl2(s)
La réaction nette d’oxydation est la formation de chlorure mercureux.
Avantages de l'électrode au calomel :
- Relativement plus facile à fabriquer et à entretenir que l'électrode à hydrogène standard (SHE)
- Composé de pâte solide et de mercure liquide, ce qui le rend pratique à utiliser
- Ne nécessite pas de pont salin séparé car il contient déjà un tube latéral avec une solution de KCl
- Le potentiel ne change pas sensiblement avec le temps et de légers changements de température
Inconvénients de l’électrode au calomel :
- Une compensation du potentiel est nécessaire lors de la mesure des potentiels des demi-cellules
- Ne peut pas être utilisé dans la mesure de potentiels où les ions K+ et Cl– interfèrent
- Le potentiel d'oxydation dépend de la concentration de KCl, donc les changements de concentration peuvent affecter le potentiel de l'électrode.
Description et procédé de l'électrode Argent-Chlorure d'Argent
L'électrode argent-chlorure d'argent est largement utilisée comme électrode de référence en raison de son prix abordable et de sa moindre toxicité par rapport à l'électrode Calomel. Cette électrode est constituée d'argent massif et de son sel précipité, AgCl. Il est fabriqué en enduisant un fil d’argent massif avec AgCl et en l’immergeant dans un tube de solution de KCl et AgCl.

Fonctionnement : L'électrode argent-chlorure d'argent permet aux ions de se former et aux électrons d'entrer et de sortir du système d'électrodes. Elle peut servir d’électrode de référence lorsqu’elle est couplée à une autre électrode.
Avantages de l'électrode argent-chlorure d'argent :
- Peu coûteux et largement disponible
- Moins toxique que l'électrode Calomel
- Facile à mettre en place et à reproduire
- Pratique et facile à transporter
- Compact et de plus petite taille, nécessitant peu d'espace
- Aucun pont salin séparé n'est requis car il contient déjà un tube latéral avec une solution de KCl
- Le potentiel reste relativement stable dans le temps et avec de légers changements de température
Les électrodes de référence sont essentielles dans l'analyse électrochimique car elles fournissent un potentiel stable et constant pour les mesures sensorielles. L'électrode au calomel et l'électrode au chlorure d'argent-argent sont deux exemples couramment utilisés en électrochimie aqueuse. Ils ont leurs avantages et leurs inconvénients, et leur adéquation dépend de l'application et des exigences spécifiques.
Produits associés
- Cellule électrochimique électrolytique pour l'évaluation des revêtements
- Cellule électrolytique de type H Triple Cellule électrochimique
- Électrode en feuille de platine pour applications de laboratoire et industrielles
- Cellule électrochimique de corrosion plane
- Électrode Électrochimique en Feuille d'Or Électrode en Or
Articles associés
- L'architecture de la précision : pourquoi les détails invisibles font le succès électrochimique
- Le paradoxe de la transparence : maîtriser l'art fragile des cellules électrolytiques
- Techniques avancées de cellule électrolytique pour la recherche de pointe en laboratoire
- Le fragile vaisseau de la vérité : manifeste de maintenance pour les cellules électrolytiques
- Jauges d'épaisseur de revêtement portatives : Mesures précises pour la galvanoplastie et les revêtements industriels