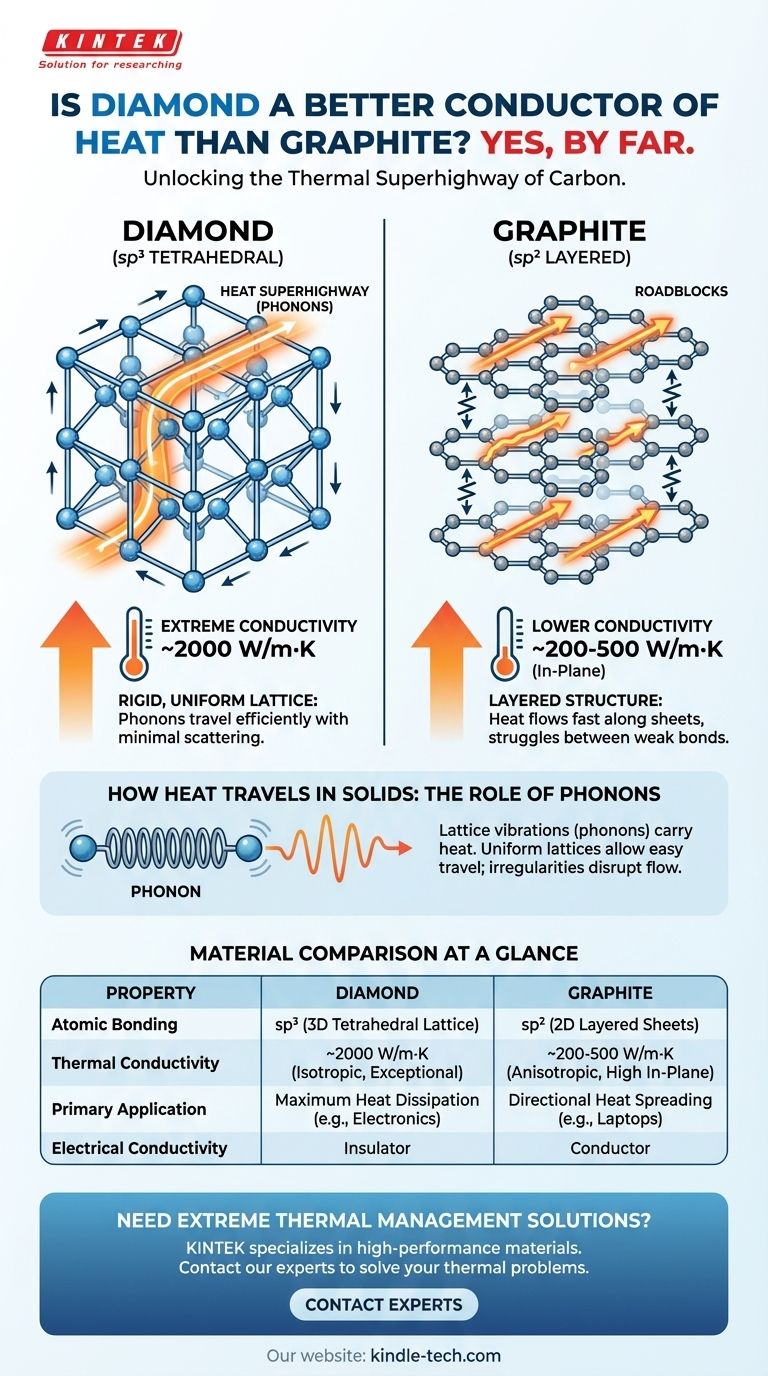
Oui, le diamant est un conducteur thermique bien supérieur au graphite. Bien que les deux soient des formes pures de carbone, la structure atomique unique du diamant lui permet de transférer la chaleur avec une efficacité extrême, ce qui en fait l'un des meilleurs conducteurs thermiques de tous les matériaux connus à température ambiante. Sa conductivité thermique peut être plus de cinq fois supérieure à celle du cuivre et bien plus élevée que celle du graphite.
La raison principale de cette différence ne réside pas dans leur composition chimique, mais dans leur architecture atomique. Le réseau rigide et tridimensionnel du diamant est une "super-autoroute" très efficace pour l'énergie thermique, tandis que la structure en couches du graphite crée des obstacles importants qui entravent le flux thermique.
Comment la chaleur se propage dans les solides : le rôle des phonons
Qu'est-ce qu'un phonon ?
Dans un solide électriquement isolant, la chaleur n'est pas transportée par les électrons mais par les vibrations du réseau. Imaginez les atomes du cristal comme étant connectés par des ressorts. Une vibration à une extrémité crée une onde qui se propage à travers toute la structure.
Ces ondes quantifiées de vibration atomique sont appelées phonons. L'efficacité de la conduction thermique dépend de la facilité avec laquelle ces phonons peuvent voyager à travers le matériau sans être diffusés ou perturbés.
L'importance d'un réseau rigide et uniforme
Un matériau parfait pour la conduction thermique possède des liaisons atomiques fortes et rigides, ainsi qu'une structure très ordonnée et uniforme. Cela permet à l'énergie vibratoire (phonons) de se propager proprement avec une résistance minimale.
Toute irrégularité, impureté ou faiblesse dans le réseau agit comme un point de diffusion, perturbant le flux de phonons et réduisant la conductivité thermique.
L'avantage du diamant : un réseau parfait pour le transfert de chaleur
La structure tétraédrique à liaisons sp³
Chaque atome de carbone dans un diamant est lié à quatre autres atomes de carbone dans un arrangement tétraédrique. Cette liaison sp³ se répète dans les trois dimensions, créant un réseau cubique incroyablement solide, rigide et continu.
C'est cette structure qui fait du diamant le matériau naturel le plus dur connu. Il n'y a pas de points faibles ou de plans au sein du cristal.
Pourquoi cette structure excelle dans le transport des phonons
Le réseau rigide et parfaitement uniforme du diamant est un milieu idéal pour le transport des phonons. Les fortes liaisons covalentes permettent à l'énergie vibratoire de voyager à des vitesses très élevées avec très peu de diffusion.
Cela fait du diamant un conducteur thermique exceptionnel, avec une conductivité d'environ 2000 W/m·K. C'est pourquoi le diamant est utilisé comme dissipateur thermique pour les composants électroniques de haute puissance où la dissipation de la chaleur est critique.
La limitation du graphite : une histoire de deux directions
La structure en couches à liaisons sp²
Dans le graphite, chaque atome de carbone n'est lié qu'à trois autres dans une feuille hexagonale plate. Cette liaison sp² est très forte, mais seulement dans le plan bidimensionnel de la feuille.
Ces feuilles sont empilées les unes sur les autres et sont maintenues ensemble par des forces beaucoup plus faibles (forces de van der Waals). Cette structure en couches est ce qui permet au graphite d'être cassant et d'agir comme un bon lubrifiant, car les couches peuvent facilement glisser les unes sur les autres.
Conductivité anisotrope : rapide le long des feuilles, lente entre elles
Cette structure en couches rend la conductivité thermique du graphite anisotrope, ce qui signifie qu'elle est différente selon les directions.
La chaleur voyage très efficacement le long des feuilles hexagonales, mais elle a du mal à passer d'une feuille à l'autre à travers les liaisons faibles. La faible connexion intercouche agit comme un goulot d'étranglement majeur pour le transport des phonons.
En conséquence, la conductivité thermique globale du graphite est significativement inférieure à celle du diamant, allant typiquement de 200 à 500 W/m·K dans les plans et beaucoup moins entre eux.
Comprendre les compromis : stabilité vs performance
Le paradoxe de la stabilité thermodynamique
Les références notent correctement qu'à température et pression standard, le graphite est la forme de carbone la plus stable thermodynamiquement. Le diamant est techniquement métastable.
Cependant, cette stabilité thermodynamique n'a aucune incidence sur ses performances thermiques. Les propriétés d'un matériau sont dictées par sa structure, et non par sa stabilité relative.
La barrière d'énergie d'activation
Le diamant ne se transforme pas spontanément en graphite, plus stable, car une très grande barrière d'énergie d'activation sépare les deux formes.
Une immense quantité d'énergie est nécessaire pour rompre les liaisons sp³ rigides du diamant afin de leur permettre de se reformer en structure sp² du graphite. Cette barrière élevée est ce qui rend les diamants effectivement permanents dans des conditions normales.
Faire le bon choix pour votre objectif
Lors de la sélection d'un allotrope de carbone, l'application dicte le choix.
- Si votre objectif principal est une dissipation thermique maximale : Le diamant est le choix inégalé, utilisé pour les dissipateurs thermiques haute performance, les outils de coupe et les substrats électroniques spécialisés.
- Si votre objectif principal est une diffusion thermique directionnelle et rentable : Les feuilles de graphite sont excellentes pour déplacer la chaleur latéralement loin d'une source, une stratégie courante dans l'électronique grand public comme les téléphones et les ordinateurs portables.
- Si votre objectif principal est la conductivité électrique ou la lubrification : Le graphite est l'option supérieure, car ses électrons délocalisés lui permettent de conduire l'électricité et ses liaisons intercouches faibles lui permettent d'agir comme un lubrifiant sec.
En fin de compte, comprendre le lien direct entre la structure atomique d'un matériau et ses propriétés physiques est la clé pour résoudre tout défi d'ingénierie.

Tableau récapitulatif :
| Propriété | Diamant | Graphite |
|---|---|---|
| Liaison atomique | sp³ (réseau tétraédrique 3D) | sp² (feuilles stratifiées 2D) |
| Conductivité thermique | ~2000 W/m·K (exceptionnelle, isotrope) | 200-500 W/m·K (anisotrope, élevée dans le plan) |
| Application principale | Dissipation thermique maximale (ex : électronique) | Diffusion thermique directionnelle (ex : ordinateurs portables) |
| Conductivité électrique | Isolant | Conducteur |
Besoin d'une solution matérielle pour une gestion thermique extrême ?
KINTEK est spécialisé dans les équipements de laboratoire et les matériaux haute performance, y compris les solutions thermiques avancées. Que votre projet nécessite la dissipation thermique inégalée du diamant ou les propriétés directionnelles et rentables du graphite, notre expertise peut vous aider à sélectionner le matériau parfait pour votre application spécifique.
Contactez nos experts dès aujourd'hui pour discuter de la manière dont nous pouvons améliorer les capacités de votre laboratoire et résoudre vos problèmes thermiques les plus complexes.
Guide Visuel
Produits associés
- Diamant CVD pour applications de gestion thermique
- Dômes en diamant CVD pour applications industrielles et scientifiques
- Dissipateur thermique ondulé plat en céramique de carbure de silicium (SiC) pour céramiques fines avancées d'ingénierie
- Plaquettes de coupe en diamant CVD pour l'usinage de précision
- Système de réacteur de machine MPCVD à résonateur cylindrique pour dépôt chimique en phase vapeur par plasma micro-ondes et croissance de diamants de laboratoire
Les gens demandent aussi
- Quels sont les avantages de l'utilisation du titane ? Obtenez une résistance et une résistance à la corrosion inégalées
- Quelles sont les méthodes de séchage courantes utilisées en laboratoire et leurs inconvénients ? Choisissez la bonne méthode pour protéger vos échantillons
- Comment la pression affecte-t-elle la pyrolyse ? Contrôler les rendements des produits, du bio-huile au syngaz
- Quel est le but principal d'un condenseur dans les expériences EODS ? Empêcher la volatilisation et assurer l'exactitude des données
- Les métaux sont-ils faciles à comprimer ? Découvrez la physique derrière leur incroyable résistance
- Quelles sont cinq applications du brasage ? De l'électronique à l'art, maîtriser l'assemblage des matériaux
- Quel est le but de l'équipement de filtration sous vide dans la lixiviation du gallium ? Atteindre une efficacité de séparation solide-liquide rapide
- Qu'est-ce que le brasage en four ? Un processus à haut volume pour joindre des composants



















