En termes techniques, une cellule d'électrolyse est un type spécifique de cellule électrochimique. Bien qu'elle relève de cette vaste catégorie, il est essentiel de comprendre que "cellule électrochimique" décrit également un autre dispositif – la cellule galvanique – qui remplit la fonction exactement opposée.
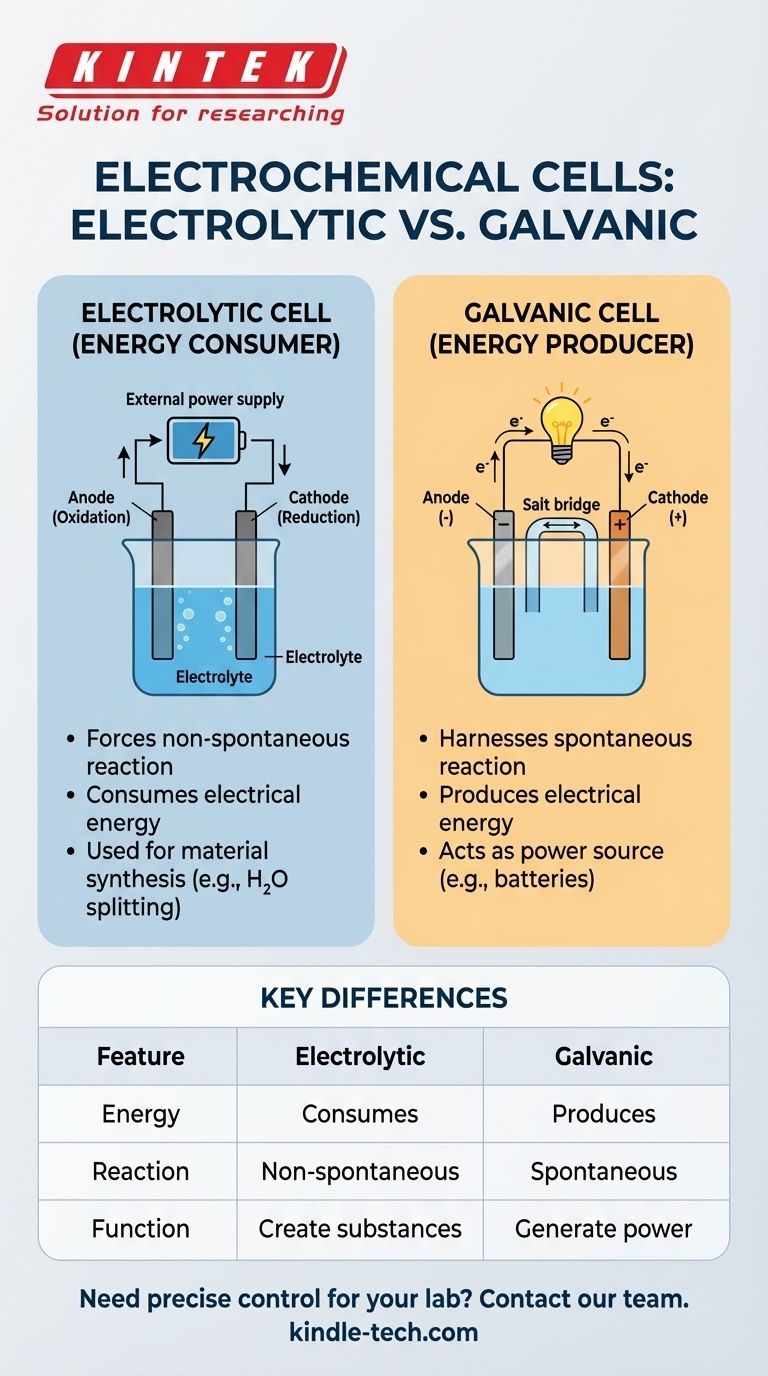
La distinction cruciale est la suivante : Une cellule d'électrolyse utilise de l'énergie électrique externe pour forcer une réaction chimique qui ne se produirait pas d'elle-même. Elle consomme de l'énergie. En revanche, une cellule galvanique (comme une batterie) utilise une réaction chimique spontanée pour produire de l'énergie électrique.

La fonction principale : Forcer une réaction chimique
Qu'est-ce que l'électrolyse ?
L'électrolyse est le processus qui consiste à utiliser un courant électrique continu (CC) pour provoquer une réaction chimique non spontanée. En termes simples, il s'agit d'utiliser l'électricité pour provoquer un changement chimique.
Le dispositif où ce processus se produit est la cellule d'électrolyse ou cellule électrolytique.
Le rôle de l'alimentation externe
La caractéristique déterminante d'une cellule électrolytique est son besoin d'une source d'alimentation externe, telle qu'une batterie ou une alimentation électrique. Cette tension externe surmonte la barrière énergétique naturelle de la réaction, forçant les produits chimiques à réagir.
Composants clés
Une cellule électrolytique se compose de deux électrodes, une anode et une cathode, immergées dans une solution liquide appelée électrolyte. La source d'alimentation externe attire les électrons de l'anode (oxydation) et les pousse vers la cathode (réduction), entraînant le changement chimique souhaité.
Électrolytique vs. Galvanique : Le parapluie "Cellule Électrochimique"
Le terme cellule électrochimique est une catégorie parente pour tout dispositif qui convertit l'énergie chimique en énergie électrique et vice versa. Comprendre les deux types principaux est essentiel pour la clarté.
Cellules électrolytiques : Consommatrices d'énergie
Ces cellules consomment de l'énergie électrique pour produire un changement chimique. Leur but principal est de créer des substances ou de modifier des matériaux par le biais d'une réaction forcée.
Un exemple courant est l'utilisation d'une cellule électrolytique pour diviser l'eau (H₂O) en hydrogène et en oxygène gazeux, un processus qui nécessite un apport énergétique important.
Cellules galvaniques (voltaïques) : Productrices d'énergie
Ces cellules font le contraire. Elles exploitent une réaction chimique spontanée pour générer un courant électrique. C'est le principe fondamental de toutes les batteries courantes.
Lorsque vous utilisez une batterie, vous utilisez une cellule galvanique pour convertir l'énergie chimique stockée en énergie électrique utilisable.
Pourquoi la distinction est importante
Appeler une cellule électrolytique une "cellule électrochimique" est techniquement correct mais imprécis. C'est comme appeler un carré un "rectangle". Bien que vrai, cela omet les propriétés spécifiques qui le définissent. La différence clé est toujours la direction de la conversion d'énergie.
Applications courantes et compromis
Où l'électrolyse est utilisée
La capacité de forcer des réactions chimiques a une immense valeur industrielle. Les cellules électrolytiques sont essentielles pour produire de l'hydrogène pur pour le carburant, affiner des métaux comme l'aluminium et le cuivre à partir de minerai, et électroplaquer des objets avec une fine couche de métal comme le chrome ou l'or.
Le principal compromis : Le coût énergétique
La principale limitation de l'électrolyse est sa forte consommation d'énergie. Parce que vous forcez une réaction non spontanée, le processus nécessite toujours plus d'énergie que l'énergie chimique que vous stockez ou la valeur du produit que vous créez. Ce coût énergétique est la principale considération économique et environnementale pour tout processus d'électrolyse industrielle.
Comment identifier la bonne cellule pour votre objectif
- Si votre objectif principal est de stocker de l'énergie ou de créer des matériaux (comme le carburant hydrogène ou l'aluminium pur) : Vous avez affaire à une cellule électrolytique, qui consomme de l'électricité pour provoquer une réaction chimique.
- Si votre objectif principal est de générer de l'énergie à partir d'une source chimique (comme une batterie) : Vous avez affaire à une cellule galvanique (ou voltaïque), qui produit de l'électricité à partir d'une réaction spontanée.
- Si votre objectif principal est le domaine scientifique général couvrant les deux processus : Vous devriez utiliser le terme générique cellule électrochimique.
En fin de compte, comprendre la direction du flux d'énergie – qu'elle soit consommée ou produite – est la clé pour distinguer ces dispositifs fondamentaux.
Tableau récapitulatif :
| Caractéristique | Cellule électrolytique | Cellule galvanique |
|---|---|---|
| Conversion d'énergie | Consomme de l'énergie électrique | Produit de l'énergie électrique |
| Type de réaction | Non spontanée (forcée) | Spontanée |
| Fonction principale | Créer des substances (ex. H₂, métaux raffinés) | Générer de l'énergie (ex. batteries) |
| Source d'alimentation | Nécessite une source externe (ex. batterie, alimentation électrique) | Est la source d'alimentation elle-même |
Besoin d'un contrôle précis sur les réactions chimiques dans votre laboratoire ?
Que votre recherche implique la synthèse de matériaux, l'électroplacage ou le stockage d'énergie, disposer du bon équipement est essentiel. KINTEK est spécialisé dans les équipements de laboratoire et les consommables de haute qualité, y compris les cellules électrochimiques et les alimentations électriques, conçus pour la fiabilité et la précision.
Laissez nos experts vous aider à choisir la configuration parfaite pour votre application spécifique. Contactez notre équipe dès aujourd'hui pour discuter de vos besoins en laboratoire et découvrir comment KINTEK peut soutenir vos objectifs de recherche.
Guide Visuel
Produits associés
- Cellule électrochimique électrolytique à cinq ports
- Bain-marie électrolytique à cinq ports à double couche
- Cellule électrolytique électrochimique à bain-marie double couche
- Cellules d'électrolyse PEM personnalisables pour diverses applications de recherche
- Cellule électrolytique de type H Triple Cellule électrochimique
Les gens demandent aussi
- Quel est le volume typique de la cellule électrolytique Raman in-situ ? Explorez les options standard de 20 ml et personnalisées.
- Quel est le but d'une cellule électrolytique de type H avec du verre fritté ? Empêcher la redéposition d'ions et assurer l'intégrité des données
- Comment entretenir une cellule électrolytique en acrylique ? Prolongez sa durée de vie grâce à un entretien approprié
- Quelles sont les exigences pour une cellule électrolytique avec une fenêtre en quartz ? Assurer des tests de performance PEC précis
- Quel rôle joue un système de cellule électrolytique dans la pré-charge d'hydrogène des métaux ? Accélérez les tests de matériaux avec KINTEK
- Quelles étapes d'inspection doivent être effectuées avant d'utiliser une cellule électrolytique ? Un guide pour des expériences sûres et précises
- Comment un poste de travail électrochimique aide-t-il à évaluer la résistance à la corrosion ? Quantification des performances de l'acier reformé au laser
- Pourquoi un système de refroidissement externe est-il nécessaire pour un réacteur électrolytique ? Prévenir la défaillance du revêtement dans le PEO de l'aluminium



















